
3.1. Узнавание и ответная реакция
Многие аспекты поведения клеток свидетельствуют об их ярко выраженной специфичности, связанной с принадлежностью к определенной ткани, биологическому виду или индивидууму. Особые "узнающие" участки, которые в значительной степени определяют эту специфичность, находятся на поверхности клетки и доступны для взаимодействия с другими клетками. Эти участки были идентифицированы главным образом иммунологически.
Если клетка млекопитающего-донора попадает в организм реципиента, она становится объектом "пристального внимания" его защитных механизмов. Последние складываются из двух компонентов - гуморального и клеточного. Химические компоненты поверхности клетки донора распознаются организмом реципиента как чужеродные и атакуются специфическими антителами, присутствующими в тканевых жидкостях (humors). В этом взаимодействии, кроме того, принимают участие особые вещества (система компонента), способствующие склеиванию (агглютинации) клеток, а затем и фагоцитозу. В отсутствие таких антител клетка донора опознается циркулирующими лимфоцитами; установив ее чужеродность для данного организма, лимфоциты атакуют ее. Это приводит к уничтожению или отторжению чужеродного материала и образованию специфических антител и лимфоцитов-"убийц".
Химическая идентификация некоторых из этих "узнающих" участков, в частности тех, в состав которых входят гликопротеиды с углеводной детерминантной группой, основана на использовании антисывороток, которые позволяют выявить антигенные свойства молекулярных комплексов, выделенных из клеточной поверхности. С помощью протеолитических ферментов (например, трипсина) от клеточной поверхности эритроцитов, а также различных клеток, выращенных в культуре, удается отделить гликопептиды с нативными гетеросахаридными цепями, сохраняющие способность к взаимодействию с антителами.
Большой вклад в изучение иммунологической роли углеводов внесли также опыты с ферментами, отщепляющими углеводный остаток от гликопептидов, например с нейраминидазой, отщепляющей N-ацетилнейраминовую (сиаловую) кислоту. Было показано, что соответствующие гетеросахаридные цепи на поверхности эритроцитов содержат от двух до шести углеводных остатков. Наиболее часто встречающиеся концевые группы этих гетеросахаридов - сиаловая кислота и L-фукоза (рис. 49). Остальные углеводные остатки принадлежат глюкозе, галактозе, маннозе и их ацетилированным производным. Углеводные цепи связаны с белковой молекулой гликопептидными связями между β-D-N-ацетилглюкозамином и аспарагином (связь, устойчивая к действию щелочи), между α-D-N-галактозамином и серином или треонином (связь, чувствительная к действию щелочи) и, вероятно, между глюкозой или галактозой и оксилизином. Основной гликопротеид эритроцитной мембраны состоит на 60% из углеводов и на 40% из пептидов и несет несколько антигенных детерминант, в том числе группоспецифические антигены крови А, В, М и N.
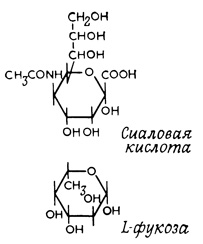
Рис. 49. Наиболее часто встречающиеся концевые группы гетеросахаридных цепей, находящихся на поверхности эритроцитов
Некоторые антигенные детерминанты эритроцитов, в том числе определяющие групповую специфичность - А, В и Н, - представлены концевыми углеводными остатками гликолипидов (гл. 6). Последние представляют собой сложные липиды, в которых олигосахаридные цепи связаны с церамидным остатком (рис. 50).
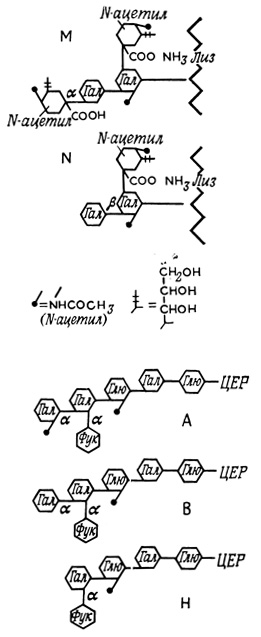
Рис. 50. Группоспецифические антигены крови. Гал - галактоза; Глю - глюкоза; ЦЕР - остаток церамида
Специфичность антигена определяется, по-видимому, размером и формой гетеросахаридного компонента. Разнообразные последовательности углеводных остатков, соединенных между собой различными типами связей, создают многообразие форм гетеросахаридных компонентов, даже если полисахарид состоит всего из нескольких типов углеводных остатков. Это многообразие еще усиливается нековалентными взаимодействиями моносахаридных остатков с соседними гетеросахаридами и белками.
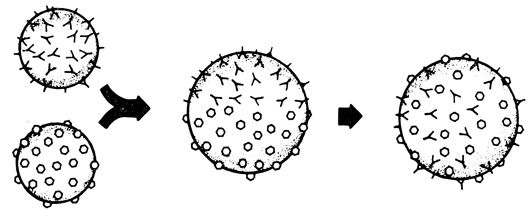
Рис. 51. Образование гетерокариона, дающего флуоресценцию промежуточной окраски. Объяснения см. в тексте
Попытки выяснить распределение антигенных детерминант на поверхности клетки привели первоначально к противоречивым результатам. Некоторые данные указывали на их диффузное распределение, другие можно было интерпретировать как свидетельство в пользу неравномерного распределения. Два направления исследований, проведенных в последнее время, позволили связать указанные расхождения с пассивным или метаболически контролируемым движением антигенов по клеточной поверхности в условиях эксперимента. Если две линии клеток, выращенных в культуре, пометить различно окрашенными флуоресцирующими антителами, специфичными в отношении их поверхностных антигенов, а затем создать условия для слияния этих клеток с образованием гетерокарионов, то комплексы антиген - антитело распределятся по всей поверхности гетерокариона, давая флуоресценцию промежуточной окраски (рис. 51). В другой серии экспериментов наблюдали распределение на поверхности лимфоцитов флуоресцирующих и меченных ферритином антител, специфичных в отношении иммуноглобулинов. Первоначально антитела распределялись диффузно, однако связывание их приводило к агрегации метки с образованием скоплений, которые затем мигрировали к одному полюсу клетки (рис. 52), где происходил пиноцитоз меченого комплекса. Процессы миграции и пиноцитоза требовали затраты энергии. Подобное перераспределение антигенов является, возможно, общей реакцией клеточной поверхности на присутствие чужеродного материала. Эти эксперименты свидетельствуют о том, что по крайней мере некоторые из гликопротеидных и гликолипидных молекул, входящих в состав плазматической мембраны, способны перераспределяться в пределах этой мембраны.
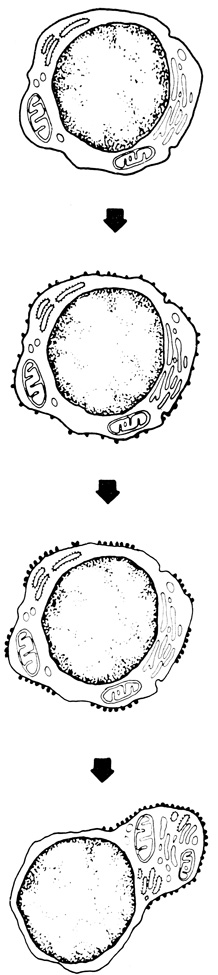
Рис. 52. Распределение на поверхности лимфоцитов флуоресцирующих и меченных ферритином антител, специфичных в отношении иммуноглобулинов
Заряд клеточной поверхности, несомненно, играет важную роль в разнообразных взаимодействиях клеток, однако роль эту мы еще не научились описывать количественно. Можно ожидать, что заряд оказывает существенное влияние на химические взаимодействия, регулируя сближение и ориентацию взаимодействующих компонентов, а также изменяя такие условия, как концентрация ионов и значение pH. Так, было установлено, что значение pH на уровне клеточной поверхности примерно на 0,3-0,4 единицы меньше, чем в окружающей среде.
Поверхность изолированной клетки несет обычно отрицательный заряд, который легко обнаружить и оценить количественно методом микроэлектрофореза*. Этот отрицательный заряд складывается из зарядов карбоксильных групп сиаловой кислоты, аминокислотных остатков и фосфатных групп (рис. 53). Не исключено, что эти группы появляются или исчезают на поверхности клеток в результате различных процедур, применяемых в процессе выделения, и поэтому нельзя с полной определенностью судить о числе заряженных групп на поверхности нативных клеток, особенно входящих в состав специализированных тканей. Так, хотя карбоксильные группы сиаловой кислоты вносят существенный вклад в общий заряд клеточной поверхности, их удаление при обработке нейраминидазой не сопровождается соответствующим снижением электрофоретической подвижности клетки.
* (Опухолевые клетки имеют, как правило большую электрофоретическую подвижность и больший поверхностный отрицательный заряд, чем нормальные. - Прим. ред.)
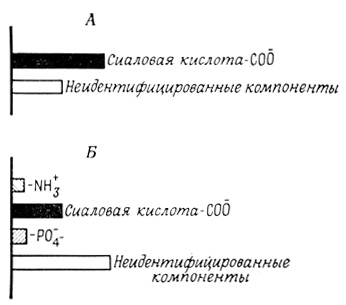
Рис. 53. Участие различных заряженных групп в образовании отрицательного заряда на клеточной поверхности эритроцитов (А) и лимфоцитов (Б) человека
Наличие заряженных групп на поверхности клеток приводит к образованию диффузного двойного электрического слоя, в котором заряд поверхности уравновешен зарядом противоположного знака, создаваемым окружающей средой (рис. 54). Потенциал, создаваемый поверхностным зарядом, уменьшается по экспоненте с увеличением расстояния от поверхности (рис. 55). Когда клетка движется в окружающей среде, она увлекает за собой тонкий слой среды, содержащий некоторую часть противоионов. Соответственно потенциал поверхности сферы (дзета-потенциал), измеренный кинетическими методами, например методом электрофореза, на несколько милливольт ниже истинного потенциала поверхности. Дзета-потенциал, измеренный для разных клеток, варьировал от -10 до -30 мВ.
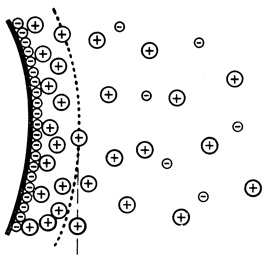
Рис. 54. Образование диффузного двойного электрического слоя, в котором отрицательный заряд поверхности уравновешен положительным зарядом, создаваемым окружающей средой
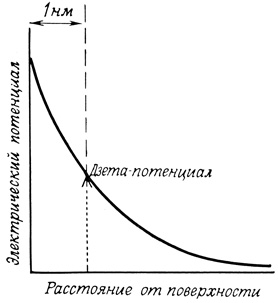
Рис. 55. График зависимости потенциала, создаваемого поверхностным зарядом, от расстояния до поверхности клетки
Потенциал, создаваемый фиксированными на поверхности зарядами, можно вычислить, используя величину дзета-потенциала, по теории Гой - Чепмена (исходящей из предположения об однородном заряде поверхности и его нейтрализации точечными противозарядами в окружающей среде) или по теории Штерна (учитывающей размер противоионов и предполагающей существование свободного от ионов слоя, непосредственно примыкающего к поверхности).
Так как при физиологических значениях pH все клетки несут отрицательный заряд, можно полагать, что между поверхностными мембранами должно возникать отталкивание. Однако, если кинетические силы или какие-либо силы притяжения преодолеют это отталкивание и приведут мембранные поверхности в непосредственное соприкосновение, фиксированные заряды распределятся на поверхностях таким образом, что удержат эти поверхности в контакте. Тем не менее электронно-микроскопические исследования показывают, что такой тип молекулярных контактов между клетками осуществляется довольно редко и ограничивается, вероятно, случаями тесного контакта и "электрического" синцития.
На трехслойных изображениях мембран виден просвет шириной от 10 до 20 нм, который иногда увеличивается при механическом воздействии на систему. Это позволяет предположить, что клетки в таких системах притягиваются друг к другу относительно слабыми силами Вандер-Ваальса - Лондона, но остаются при этом на определенном расстоянии благодаря электростатическим силам отталкивания. Диссоциирующее влияние хелатообразующих агентов, например ЭДТА, позволяет предположить, что двухвалентные ионы, в частности ионы кальция, способствуют слипанию клеток. Вполне возможно, что эти ионы снижают поверхностный потенциал или способствуют образованию контактов при участии различных межклеточных веществ, в том числе содержащих углеводы (см. гл. 1).
Способность клеток узнавать друг друга и их заряд определяют в эксперименте реагрегацию диссоциированных клеток и играют важную роль в процессах морфогенеза. Механически диспергированные клетки губки, смешанные с другой популяцией диспергированных клеток, реагрегировали строго специфически - объединялись между собой только подобные (рис. 56). Такая специфичность клеточной реагрегации наблюдалась у слизевиков, а также у клеток из различных тканей зародышей млекопитающих и земноводных. Аналогичные специфические взаимодействия лежат в основе процессов гистогенеза и установления строго определенных контактов, характерных для отростков нервных клеток.
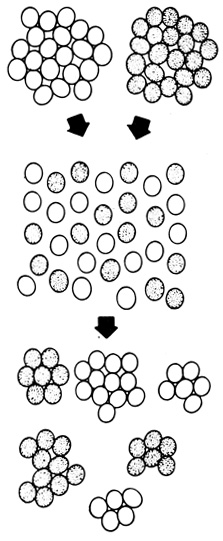
Рис. 56. Эксперимент, показывающий способность клеток узнавать друг друга. Две популяции механически диспергированных клеток смешивали друг с другом. Образовавшиеся затем агрегаты состояли из клеток только какого-то одного типа
Для взаимодействия между клетками имеют значение и некоторые другие явления на уровне клеточной поверхности, в том числе подвижность клеточной мембраны и контактное торможение. Хотя оба эти явления описаны достаточно подробно, тем не менее механизм их до сих пор не выяснен. Подвижность клеточной мембраны проявляется, например, при перемещении клеток, растущих в культуре, по субстрату, впячивании и втягивании псевдоподий. При соприкосновении с другой клеткой движение в направлении контакта прекращается, так что, оказавшись в окружении других клеток, клетка останавливается и перестает делиться. Степень контактного торможения у клеток разного типа различна, а у многих опухолевых клеток в культуре оно и вовсе отсутствует (рис. 57). Это послужило основанием для разного рода гипотез о связи злокачественности с исчезновением явления контактного торможения, однако до сих пор исследователям не удалось обнаружить никаких связанных с этим химических или структурных различий между мембранами нормальных и злокачественных клеток*.
* (В последнее время было выяснено, что злокачественные клетки в культуре отличаются укороченными олигосахаридными цепочками гликолипидов по сравнению с нормальными клетками. По мнению некоторых исследователей, это отличие непосредственно связано с утратой способности к контактному торможению. Обнаружено также, что мембраны ряда опухолевых клеток характеризуются менее специфичным составом фосфолипидов, чем соответствующие мембраны гомологичных нормальных клеток (липидная дедифференцировка мембраны). - Прим. ред.)
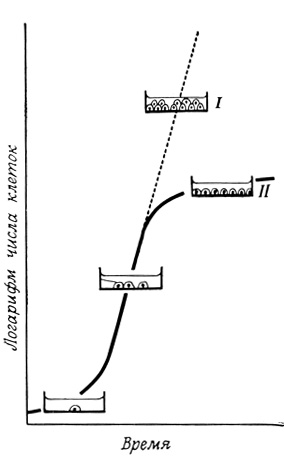
Рис. 57. Явление контактного торможения в культуре клеток. Нормальные клетки (II), растущие в культуре, при соприкосновении друг с другом останавливаются и перестают делиться; злокачественные же клетки (I) продолжают деление
Механизм движения клеточной мембраны также остается невыясненным. В фазово-контрастном микроскопе поверхность движущейся клетки или ее отростка выглядит "рифленой", а мембраны движущихся по стеклу клеток совершают волнообразные ("ундулирующие") движения. На поверхности стекла, по которому совершала свое движение клетка, удавалось обнаружить небольшие количества вещества полисахаридной природы. Это послужило основанием для предположения, что движущая сила клетки генерируется сборкой мембраны на переднем конце, что сопровождается ее растворением у "хвостового" конца. Согласно другой гипотезе, движущая сила развивается в сократительных элементах, связанных с клеточной мембраной. На электронных микрофотографиях были обнаружены нитевидные или трубчатые структуры, примыкающие к внутренней поверхности клеточной мембраны. Предполагается, что эти структуры представляют собой сократительные элементы, определяющие различные виды активности клетки, в том числе подвижность мембраны, например при образовании псевдоподий, экзоцитозе и эндоцитозе. Некоторые из этих явлений обсуждаются более подробно в гл. 4.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'