
5.4. Векторные ферменты
Многие ферменты, связанные с мембранами, катализируют реакции, целиком протекающие по одну сторону мембраны. Однако другие принимают субстрат(ы) на одной стороне мембраны и выделяют продукт(ы) на противоположной стороне, придавая реакции векторный характер. Ограниченная проницаемость мембран обеспечивает при этом разделение компонентов реакции и образование ферментами концентрационных градиентов.
Такие векторные ферменты должны каким-то образом "прошивать" всю толщу мембраны, а их активность in vitro не должна проявляться, если субстрат находится на "неправильной" стороне мембраны. Ситуация еще более усложняется (по сравнению с невекторными ферментами, связанными с мембранами), если для протекания ферментативной реакции необходимо правильное пространственное распределение всех компонентов реакции. Примером такой системы является (Na+/K+)-АТФаза плазматических мембран, вызывающая векторное движение ионов Na+ и К+ в противоположных направлениях. Активность этого фермента на одной стороне мембраны зависит от присутствия МgАТФ, а на другой стороне ингибируется аубаином (гл. 2).
Более подробные сведения о некоторых векторных ферментах можно найти в специально посвященной этому вопросу литературе. (Na+/K+)-зависимая АТФаза, Са2+-зависимая АТФаза и HCO3--зависимая АТФаза соответственно обеспечивают движение ионов Na+ и К+, Ca2+ и H+ через приспособленные для этой цели мембраны (гл. 2). Связанные с мембранами рибосомы высвобождают молекулы новообразованных белков в цистерны эндоплазматической сети (гл. 4). Фосфоенолпируватзависимая ферментная система бактерий фосфорилирует сахара, поступающие из внеклеточной среды, и транспортирует их в клетку (гл. 2). По мнению некоторых исследователей, глюкозо-6-фосфатаза из тканей млекопитающих также представляет собой векторный фермент. Этот фермент гидролизует глюкозо-6-фосфат, поступающий из цитоплазмы, и, вероятно, выделяет один из продуктов реакции, глюкозу, в цистерны эндоплазматической сети.
Большой интерес вызвало предположение о том, что транспорт электронов в митохондриях и в хлоропластах является векторным процессом, при котором образуются ионные градиенты (и генерируется мембранный потенциал). Такие ионные градиенты могут обеспечивать энергией процесс синтеза АТФ (рис. 105). В соответствии с химио-осмотической гипотезой (гипотеза Митчелла) транспорт электронов по окислительновосстановительной цепи осуществляется переносчиками, так ориентированными в мембране, что протоны, захваченные на одной стороне мембраны и высвобождающиеся в результате окислительно-восстановительных реакций, всегда выбрасываются по другую сторону мембранного барьера. В результате этого процесса на мембране возникают противоположно направленные градиенты протонов и гидроксил-ионов.
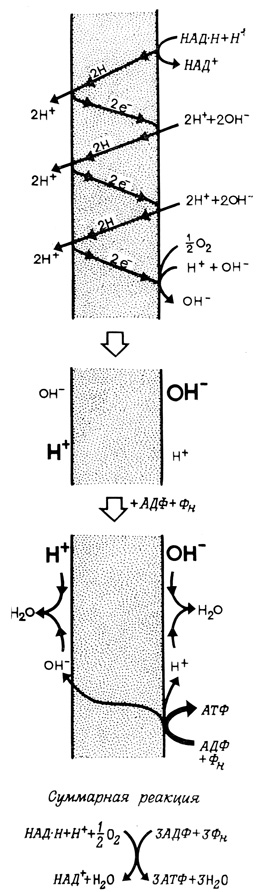
Рис. 105. Образование ионных градиентов и синтез АТФ
Полагают, что выравнивание ионных градиентов (и падение потенциала), сопровождающееся синтезом АТФ, осуществляется другой векторной ферментной системой. Синтез АТФ из АДФ и неорганического фосфата включает реакцию конденсации, т. е. отрыв от этих молекул элементов воды (H+ и OH-). Если при этом H+ и OH- выделяются по разные стороны мембраны, то происходит нейтрализация этих зарядов за счет градиентов, возникших в результате транспорта электронов. В отсутствие протонного градиента система работает в обратном направлении, т. е. гидролизует АТФ, и, следовательно, в определенных условиях она будет проявлять АТФазную активность.
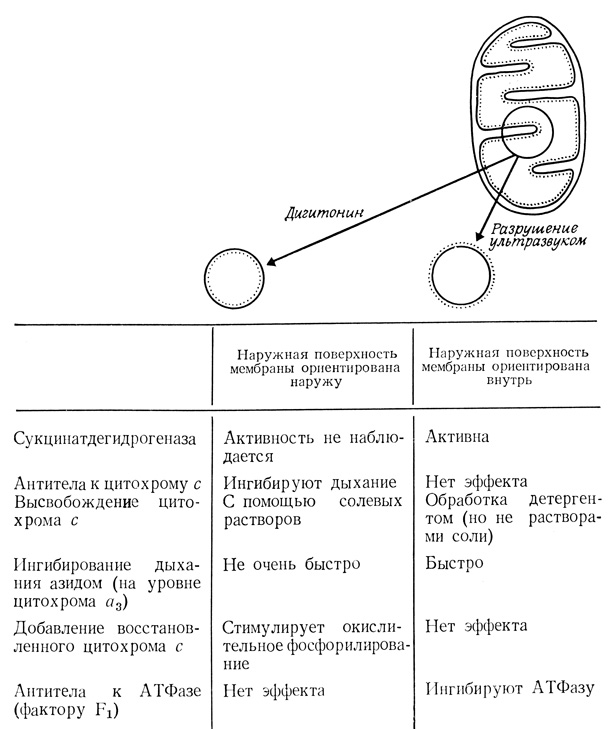
Рис. 106
Различные аспекты химио-осмотической гипотезы подтверждаются результатами некоторых экспериментов: 1) дыхание в митохондриях сопровождается быстрым закислением инкубационной среды и защелачиванием матрикса; 2) синтез АТФ протекает только в тех препаратах митохондрий или субмитохондриальных частиц, где мембрана сохранила свои изолирующие свойства (добавление к системе агентов, разрушающих мембранные структуры, например детергентов, приводит к ликвидации протонного градиента и к подавлению окислительного фосфорилирования); 3) агенты, разобщающие окислительное фосфорилирование, такие, как динитрофенол, увеличивают протонную проводимость мембраны; 4) для некоторых компонентов в цепи транспорта электронов, а также АТФазной системы митохондрий установлено асимметричное расположение в мембране.
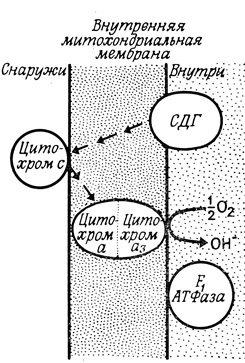
Рис. 107. Возможная локализация компонентов дыхательной цепи и цепи окислительно - восстановительного фосфорилирования. СДГ - сукцинатдегидрогеназа
Ряд факторов не согласуется с химио-осмотической гипотезой: 1) кажущееся отсутствие на мембране высоких потенциалов, которых можно было бы ожидать в соответствии с этой гипотезой; 2) несоответствие между числом окислительно-восстановительных компонентов дыхательной цепи, наблюдаемым в опытах, и числом этих компонентов, учтенных в схеме Митчелла, и 3) неортодоксальная последовательность окислительно-восстановительных компонентов в схеме Митчелла*.
* (Большой вклад в разработку химио-осмотической теории внесли советские исследователи Скулачев и Либерман. Выяснив механизм функционирования разобщающих агентов, они сумели предсказать характер действия многих веществ на митохондрии и открыть новые типы разобщающих агентов. На основе этих предсказаний они ввели в практику исследования мембран новые типы катионов и анионов, оказавшиеся весьма полезными для определения направления потока электронов в митохондриях и мембранных пузырьках (если поток электронов направлен снаружи пузырька внутрь, то добавленные снаружи катионы должны перемещаться извне внутрь; если же электроны "передвигаются" в противоположном направлении, то внутрь должны перемещаться наружные анионы). Недавно в лаборатории Скулачева было доказано, что ферментные системы окислительного фосфорилирования и фотофосфорилирования способны генерировать высокие потенциалы, что снимает один из доводов, выдвигаемых против гипотезы Митчелла. - Прим. ред.)
Альтернативная "химическая" гипотеза окислительного фосфорилирования постулирует образование высокоэнергетических фосфорилированных и нефосфорилированных промежуточных продуктов, посредством которых осуществляется сопряжение процессов транспорта электронов и фосфорилирования АДФ. Эта гипотеза адекватно объясняет большинство явлений, связанных с окислительным фосфорилированием, исходя из транспорта электронов по дыхательной цепи. Однако до сих пор ни одного из постулированных высокоэнергетических промежуточных продуктов не удалось выделить из митохондриальной мембраны и охарактеризовать.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'