
6.3. Пространственные взаимоотношения
Наиболее надежная информация о пространственном распределении белковых и липидных компонентов в мембранах была получена с помощью электронной микроскопии и рентгеноструктурного анализа ряда наиболее подходящих мембранных систем. Миелиновая оболочка нервного волокна и фоторецепторные клетки сетчатки (колбочки и палочки), которые представляют собой правильно организованные многослойные структуры, легко поддаются исследованию методом рентгеноструктурного анализа без специальной обработки. Интерпретация дифракционной картины позволила выделить в мембране три слоя. Два слоя, прилегающие к поверхностям, содержат материал с высокой электронной плотностью, а центральный слой - материал с низкой электронной плотностью. В случае миелиновых мембран минимальная электронная плотность центрального слоя соответствует электронной плотности жидких углеводородов. Таким образом, профиль электронной плотности мембран хорошо согласуется с идеей существования бимолекулярного липидного слоя, центральная область которого сформирована углеводородными цепями, т. е. находится в малоупорядоченном жидком состоянии. Фосфатные группы фосфолипидных молекул обращены к поверхностям двойного слоя, формируя, по-видимому, области с высокой электронной плотностью. Значительные участки гидратированных молекул белков лежат, вероятно, вне липидного слоя (рис. 117).
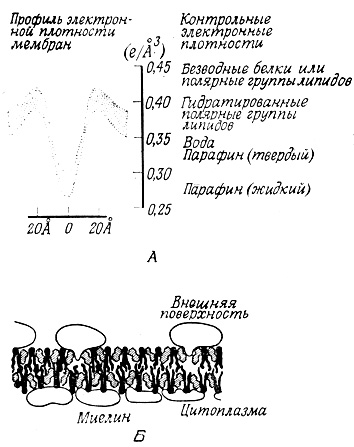
Рис. 117. Дифракционная картина, полученная при изучении миелина (А), и схема строения миелина (Б)
Данные о структуре мембран палочек сетчатки лучше всего согласуются с предположением о том, что белковые компоненты мембраны "внедряются" в липидный слой и занимают примерно 30% объема углеводородной фазы. Имеются указания на то, что степень внедрения родопсина (основного белкового компонента этих мембран) усиливается при "выцветании" зрительного пурпура под действием на сетчатку света.
Что касается других мембран, которые для получения дифракционной картины приходится подвергать особой очистке и выделять в виде концентрированных препаратов, то рентгеноструктурные данные о них значительно менее подробны, однако эти данные не оставляют сомнений в том, что центральная область различных мембран состоит из материала с низкой электронной плотностью, что согласуется с гипотезой бимолекулярного липидного слоя. Сравнительное изучение природных и искусственных мембран с помощью самых разнообразных методов (дифференциальная термическая калориметрия, ядерный магнитный резонанс, замораживание со скалыванием (рис. 118), измерение электрических параметров и проницаемости неэлектролитов) продемонстрировало большое сходство обеих систем. Во всех исследованных случаях было убедительно доказано, что липиды образуют в мембране бимолекулярный слой, расположенный в центре.
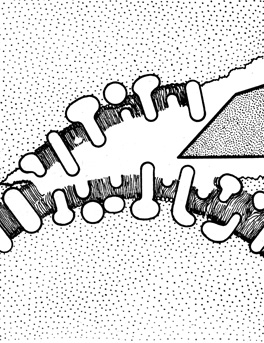
Рис. 118. Метод получения сколов с мембран
Локализация белков в мембране отличается большим разнообразием. В мембранах миелиновой оболочки белки лежат на поверхностях липидного слоя, а относительно некоторых других мембран доказано внедрение белковых молекул в липидный слой; иногда они как бы "прошивают" мембрану насквозь (рис. 119). Наиболее распространенный и надежный метод изучения степени внедрения белков в мембрану - это метод замораживания со скалыванием. Благодаря особому способу приготовления препарата на микрофотографиях видна неполярная область мембраны. Общепризнано, что выступы, определяемые на репликах с поверхности сколов, соответствуют белковым компонентам, внедрившимся в углеводородную область мембраны. Подобные исследования мембран эритроцитов показали, что белковые молекулы занимают в них примерно 30% поверхности скола. Эта величина вполне согласуется с результатами, которые были получены при изучении сжатия теней эритроцитов после вытеснения части липидов из мембранной структуры.

Рис. 119. Реплика, полученная с мембраны эритроцита
Исследование обеих поверхностей, образовавшихся при сколе, выявило существенные различия в их структуре; различия эти, по всей видимости, отражают существующую асимметрию в распределении молекулярных компонентов двух "полумембран". Об асимметрии свидетельствуют также результаты определения активности ферментов, связанных с мембраной, по их доступности для химических реагентов и действию протеиназ. Так, имеются все основания предполагать, что иммунологически активные гликопротеиды локализованы на наружной стороне клеточной мембраны. Это следует, в частности, из того, что трипсин отщепляет антигенные детерминанты (гликопептиды) от поверхности нативных клеток, а также из экспериментов с использованием химических меток. Такую локализацию гликопротеидов подтвердили электронно-микроскопические исследования с применением антител, меченных ферритином. Антигены распределены по поверхности клетки случайным образом и практически отсутствуют на внутренней стороне мембраны.
К функционально активным белкам (или гликопротеидам), локализованным на наружной поверхности плазматичной мембраны, относятся также рецепторы гормонов, некоторые ферменты и компоненты транспортных систем. Детальный анализ поведения этих систем показывает, что в некоторых случаях их активность может проявляться лишь при условии трансмембранной локализации белковых компонентов, при которой они доступны как с наружной, так и с внутренней стороны. Последнее реализуется, например, при сопряжении активности двух пространственно разобщенных белков. Так, полагают, что рецепторы гормонов находятся на наружной стороне клеточной мембраны, а аденилатциклаза - на внутренней. Известны также случаи участия одного и того же белка в процессах, протекающих по разные стороны мембраны. В подобных случаях необходимо предположить, что белковая молекула прошивает мембрану насквозь; таким примером может служить (Na++K+)-зависимая АТФаза (гл. 2). Другая транспортная система, в которой, возможно, имеет место трансмембранная локализация белка, это белок транспорта кальция (Са2+-АТФаза) в саркоплазматической сети, состоящий из одной полипептидной цепи с молекулярным весом 100 000. На долю этого белка приходится около 60% всего белка мембраны; вполне возможно, что это единственный внутренний белок данной мембранной структуры. Остальные полипептидные компоненты, обнаруженные в микросомных фракциях мышечной ткани, относятся, по-видимому, к наружным белкам, рыхло связанным с внутренней поверхностью мембраны саркоплазматической сети (рис. 120).
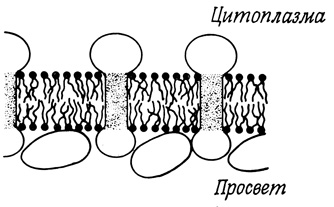
Рис. 120. Реплика, полученная с мембраны эндоплазматической сети
Метаболическая активность внутренней мембраны митохондрий служила объектом интенсивных исследований; в результате были идентифицированы многочисленные внутренние мембранные белки. Среди этих белков, составляющих вместе более 50% мембранного белка, не нашлось ни одного, на долю которого приходилось бы более 5%. Для некоторых белков удалось установить локализацию относительно внутренней (матрикс) и наружной поверхностей мембраны (гл. 5). Многие из этих белков являются компонентами цепи транспорта электронов и сопряженных с ним окислительных реакций. В состав АТФазного комплекса митохондрий (АТФаза, чувствительная к олигомицину), катализирующего фосфорцлирование АДФ, входит "большой" наружный белок (F1-АТФаза, нечувствительная к олигомицину), который взаимодействует с "малым" внутренним белком, находящимся со стороны матрикса (рис. 121).
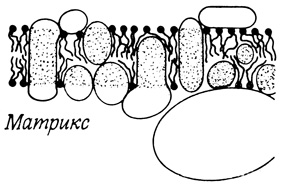
Рис. 121. Реплика, полученная с внутренней мембраны митохондрий
Характер распределения белков по поверхности, мембраны может быть различным. В большинстве мембран белки распределены равномерно по всей мембране. Для специализированных мембран характерны участки с высокой концентрацией особых белков (например, Са2+-АТФазы в мембранах саркоплазматической сети) или скопления белковых молекул (например, белки цепи транспорта электронов, встроенные во внутреннюю мембрану митохондрий). В исключительных случаях (мембраны фоторецепторов и мембрана слизистой мочевого пузыря) особый белок, присутствующий в высокой концентрации, формирует плотноупакованные молекулярные структуры, которые удается идентифицировать дифракционными методами. Такие плотноупакованные специализированные белковые структуры были обнаружены и в области клеточных контактов.
Имеются также данные об асимметричном и гетерогенном распределении липидных молекул в мембранах. Дифрактограммы миелина, полученные с высоким разрешением, свидетельствуют о более высоком содержании холестерина в наружной половине мембраны. Распределение липидов на поверхности мембраны изучалось методом введения химической метки, а также в опытах с применением фосфолипаз, гидролизующих липиды*. Так, сфингомиелиназа (отщепляющая фосфорилхолиновую полярную головку от сфингомиелина) гидролизует более половины сфингомиелина в мембране йнтактных эритроцитов, не вызывая гемолиза. Отсюда следует, что сфингомиелин находится главным образом в наружной половине мембраны, ФХ - другой липид, содержащий холин, также, по-видимому, располагается преимущественно в наружной половине эритроцитарной мембраны. Такие липиды, как ФЭ и ФС, вероятно, локализованы в основном во внутренней половине, поскольку ввести в них химическую метку, пользуясь непроникающими реагентами, не удается. Гликолипиды, которые играют столь важную роль в иммунологических процессах, по всей вероятности, принадлежат наружной половине мембраны.
* (Недавно в Институте биоорганической химии им. М. М. Шемякина АН СССР были разработаны два других способа изучения расположения липидов в мембранах. Один из них основан на изучении ЯМР-спектров мембранных препаратов в присутствии добавленных извне парамагнитных ионов, образующих комплекс с фосфолипидами. Поскольку парамагнитные ионы не проникают через мембрану, они взаимодействуют только с внешними липидам и модифицируют сигналы ядер, входящих в состав полярных головок этих липидов. Таким способом удается получить дифференцированные сигналы от липидных молекул, находящихся на наружной или внутренней поверхности мембраны. По второму способу мембрану обрабатывают специфическими липидпереносящими белками. Такие белки осуществляют перенос липидных молекул между различными мембранами, но сами не способны проникать внутрь мембран и не оказывают на них литического действия. Этим путем было установлено асимметричное расположение фосфолипидов в мембранах грамположительных бактерий. - Прим. ред.)
О гетерогенности распределения липидов по поверхности мембраны свидетельствуют результаты экспериментов, в которых изучалось влияние их фазовых переходов на активность некоторых мембранных белков. Было показано, что некоторые белки реагируют на изменение свойств своего липидного микроокружения (рис. 122). Различие между температурой фазового перехода липидов в мембране и температурой, при которой происходит изменение энергии активации ферментативной реакции, по-видимому, отражает различия в физических свойствах между липидами микроокружения белковой молекулы и основной массой липидов в мембране. Эти различия не обязательно отражают гетерогенность липидного состава мембраны, но, если изучаемая ферментативная реакция предъявляет какие-то особые требования к липидному составу, такая гетерогенность представляется весьма вероятной.
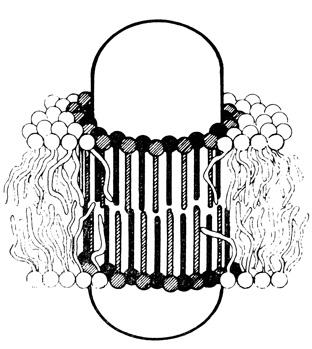
Рис. 122. Липидное микроокружение белков в мембранах
У нас сравнительно мало количественных данных о природе и силе взаимодействия между белковыми и липидными компонентами мембраны. Поскольку ни солевые растворы, ни органические растворители не способны вызывать полную диссоциацию мембран, можно считать, что в организации мембранной структуры принимают участие как полярные, так и неполярные межмолекулярные взаимодействия. Этот вывод подтверждают также данные по реагрегации изолированных компонентов мембран. Определенное указание о силе неполярных липид-белковых взаимодействий можно получить из данных по степени проникновения внутренних белков в бимолекулярный липидный слой. Как уже упоминалось при обсуждении мембранных структур, степень проникновения белков в бимолекулярный липидный слой и, следовательно, интенсивность неполярных взаимодействий варьируют в весьма широких пределах. Во взаимодействии между липидом и белком, лежащим вне липидного слоя, участвуют полярные головки липидов, и, следовательно, это взаимодействие носит полярный характер.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'