
Механические свойства межклеточных контактов (В. Ф. Ушаков)
Прочная механическая связь клеток является необходимым условием существования многих тканевых систем. Она обеспечивает определенное пространственное взаимоотношение клеток, без которого невозможно функционирование ткани как целого. Неразрывно связаны с механическими свойствами МК подвижность клеток относительно друг друга, физиологическая и патологическая деструкция контакта, видо- и тканеспецифическая сортировка клеток и т. д. (I. Vlodavsky, D. Gospodarowicz, 1981; A. Г. Маленков, 1971, 1976; М. A. Abercrombie, 1974; J. Overton, 1977). Нарушение адгезивных свойств и деформация контакта клеток сопутствуют ряду патологических процессов (Е. А. Модянова, 1970; А. Г. Маленков, 1976; Т. Н. Мосевич и др., 1975; D. R. Coman, 1944). Состояние межклеточной связи может служить чувствительным тестом на биологическую активность химических соединений и способствовать выяснению механизмов их действия на ткани (Г. А. Чуич, 1968; Ю. П. Черненко и др., 1973; В. М. Пинская, 1975; В. И Левенталь, 1976; В. П. Колотенко, 1977; А. Г. Маленков, Г. А. Чуич, 1979). Вместе с тем механические свойства МК дефинитивных тканей редко являются объектами исследований.
Методы исследования механических свойств МК. Под механическими свойствами следует понимать способность МК к деформации (изменению размеров и формы) и трансформации (передаче, противодействию) механической нагрузки. В науках о механических свойствах тел (теории сплошных сред, теории упругости, сопротивлении материалов и др.) деформируемости соответствуют перемещения, а способность трансформировать нагрузку оценивают по распределению напряжений в теле. Связь между напряжениями и деформациями, выраженная в аналитической или графической форме, является конечным результатом исследований в области механики сплошных сред.
Изучение механических свойств МК ассоциируется прежде всего с представлением о межклеточной адгезии, которая, в общем, есть способность клеток устанавливать и поддерживать устойчивый (механически прочный) контакт с другими клетками (А. Г. Маленков, 1974). Такому определению адгезии соответствует деление всех экспериментальных методик на две группы: оценивающие прочностные характеристики МК и оценивающие способность клеток устанавливать стабильный контакт (прочность контакта не определяют специально).
В настоящее время используют две прочностные характеристики контакта клеток: а) силу, необходимую для отрыва одной клетки от другой или от пласта клеток (Е. А. Модянова, 1970; D. R. Coman, 1944); б) количество клеток, отрываемое от образца ткани при стандартном механическом воздействии (Е. А. Модянова, 1970; В. И. Архипенко, Г. А. Чуич, 1968; В. И. Левенталь, Г. А. Чуич, 1976; А. Г. Меликянц, 1976).
D. R. Coman (1944) отрывал одну клетку от другой с помощью микроиглы. Силу, необходимую для отрыва одной клетки от другой, можно оценивать при этом по калиброванному прогибу иглы. Метод привлекает тем, что измеряемый показатель прочности межклеточной связи представляет собой конкретную физическую величину - силу. Это обстоятельство открывает, казалось бы, возможность исследования природы сил меж-клеточного сцепления (E. A. Modjanova, A. G. Malenkov, 1973). Однако физическая интерпретация экспериментальных результатов, полученных с помощью этого метода, сопряжена с трудностями (A. S. G. Curtis, 1973). Трудоемкость метода является существенным препятствием к его распространению и усовершенствованию.
Е. А. Модянова (1970) определяла количество выделившихся клеток из стандартной навески при дозированном раздавливании кусочка ткани. Метод используют для сравнения прочности связи клеток в двух образцах ткани. Достоинство метода - малая трудоемкость и достаточная чувствительность.
В. И. Архипенко, Г. А. Чуич (1968) предложили метод жидкостной дезинтеграции ткани для оценки сцепленности клеток в тканях. Образец ткани омывают струей изотонической жидкости и число выделившихся клеток считают показателем прочности клеточной связи. Метод позволяет учитывать прочностные свойства клеток по результатам разрушения их в суспензии (В. И. Архипенко и др., 1974). Метод не трудоемок и высокопроизводителен. Чувствительность его достаточна для изучения механизмов действия ряда гормонов in vivo (Г. А. Чуич, 1970; В. М. Пинская, 1975; В. П. Колотенко, 1977).
В. И. Левенталь, Г. А. Чуич (1976) оценивали прочность сцепления клеток по числу выделившихся клеток при продавливании кусочка ткани через отверстие. Дополнительно определяли прочность клеток и путем логического анализа делали вывод о влиянии этого параметра на прочностные свойства МК.
А. Г. Меликянц (1976) определял число оторванных клеток при больших скоростях вращения вывернутой тонкой кишки крыс. Метод использовали для исследования физико-химической природы межклеточной связи (A. G. Malenkov, A. G. Melikyants, 1977).
D. E. Brooks с соавторами (1967) считают, что критическое давление, при котором ткань проходит сквозь микросито, может служить показателем межклеточного взаимодействия.
Характерными особенностями рассмотренных методов являются: а) интенсивное механическое воздействие на клетки и их контакты; б) простота измеряемых показателей (сила отрыва, число выделившихся клеток). Этим методам соответствует отрыв друг от друга двух сплошных недеформируемых тел при постоянной внешней нагрузке, поскольку не учитываются деформации клеток и МК. Определяют предел прочности области контакта (по силе) или суммарную (по всем оторванным клеткам) площадь разрыва за определенный промежуток времени. Однако остается неизвестным характер разрушения контакта при действии применяемой в методе механической нагрузки. Это в значительной степени ограничивает возможности интерпретации экспериментальных результатов с точки зрения свойств контакта клеток.
Рассмотрим, например, ультраструктуру изолированных клеток и кусочков ткани, полученных в процессе жидкостной дезинтеграции печени крыс. Струя изотонической жидкости срывает с поверхности кусочка печени гепатоциты с частично разрушенной плазмолеммой. Разрывы клеточной поверхности составляют от 5 до 50% периметра клетки. Гиалоплазма и ядра клеток обводнены. Митохондрии находятся в высококонденсированном состоянии с расслоившимися внутренней и внешней мембранами (рис. 15). Встречаются отдельно расположенные желчные капилляры с сохранившимися участками соединительных комплексов. В кусочках ткани после жидкостной дезинтеграции обнаруживаются разрывы, проходящие по цитоплазме вблизи плотного соединения (рис. 16).
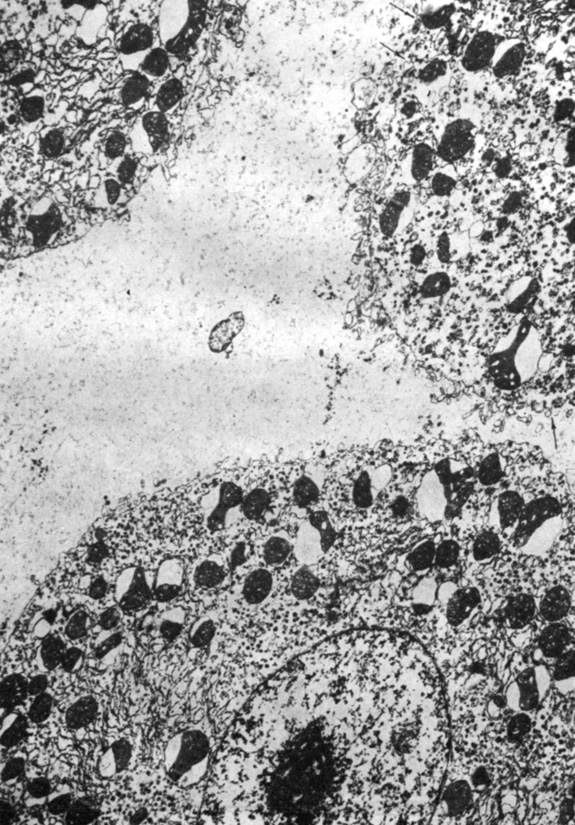
Рис. 15. Суспензия гепатоцитов крыс, полученная в процессе жидкостной дезинтеграции ткани. Стрелками обозначены разрывы клеточной поверхности. Увеличение 12 000
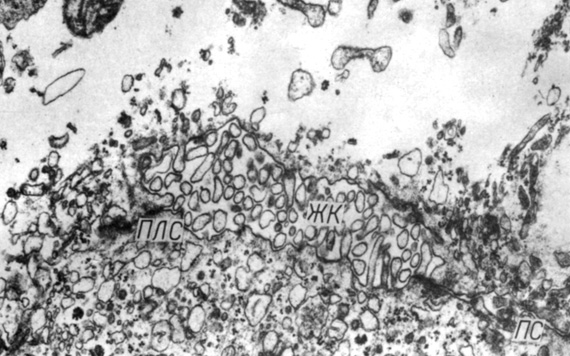
Рис. 16. Разрыв цитоплазмы вблизи контакта гепатоцитов при жидкостной дезинтеграции кусочков печени: ПЛС - плотное соединение, ЖК - желчный каналец, ПС - простое соединение. Увеличение 18 000
Таким образом, отрыв клеток струей жидкости с поверхности ткани связан с частичным разрушением клеток. Поэтому показатель клеточного сцепления - число сорванных клеток - зависит как от свойств компонент контакта (механических свойств соединений, их распределения по контактной поверхности, прочности клеточной поверхности), так и от прочности клеток. Влияние последней на показатель клеточной адгезии при жидкостной дезинтеграции можно учесть, вводя показатель прочности в расчетную формулу для числа сорванных клеток (В. И. Архипенко и др., 1974). Однако и в этом случае область контакта остается аппроксимированной однородным телом. С другой стороны, известно, что контакт клеток представляет собой сложную структуру, образованную различными по ультраструктурной и химической организации соединениями (В. И. Архипенко и др., 1975; L. A. Staehelin, 1974). Поэтому дальнейшее развитие адгезиометрических методов должно быть направлено на создание способов исследования механических свойств отдельных ультраструктурных элементов МК.
А. Г. Меликянц, А. Г. Маленков (1977) предложили оценивать механические свойства МК в эпителиальном пласте по динамике трансэпителиального потенциала в зависимости от разности осмотических или гидростатических давлений в емкостях разделенных эпителиальным пластом. Авторы считают, что такой метод позволяет по косвенным показателям судить о динамике изменений простого и плотного соединений. Однако для подтверждения такой интерпретации необходимы ультраструктурные исследования.
Для изучения механических свойств контактов на ультра-структурном уровне нужно создавать концентрации напряжений, локализованные в области отдельных соединений. Такую ситуацию удалось создать, нагнетая изотоническую жидкость в кровеносное русло печени при блокированном оттоке (В. Ф. Ушаков, 1977). Эксперименты проведены на самцах белых беспородных крыс массой 150-200 г и мышей линий С57В1 и СВА массой 18-20 г. Животных наркотизировали эфиром. Брюшную полость вскрывали и печень перфузировали in situ через воротную вену в течение 30 с для удаления крови из сосудистого русла раствором Хенкса с рН 7,4 при давлении 13 гПа и 37° С. Отток происходил через рассеченную нижнюю полую вену. Затем нижнюю полую вену лигировали выше и ниже места впадения печеночных вен и давление повышали до 26, 40, 66 и 130 гПа. Через 0,4, 0,5, 1, 5 или 10 мин заменяли раствор Хенкса охлажденным до 4° С 2,5% раствором глютарового альдегида на фосфатном буфере.
Фиксацию при повышенном давлении осуществляли в течение 3 мин. Затем из центральной доли печени вырезали кусочки размером примерно 1 мм3 и проводили электронномикроскопическое исследование.
Установлено, что повышенное гидростатическое давление в кровеносном русле печени вызывает расширение синусоидных капилляров и расхождение контактных поверхностей гепатоцитов (рис. 17). Зона расхождения поверхностей гепатоцитов распространяется от вокругсинусоидных пространств к желчным канальцам, создавая механические напряжения в области отдельных соединений. Поэтому число, протяженность и расположение сохранившихся участков соединения характеризуют его механические свойства. Кроме того, напряжение, разрывающее сохраненный участок контакта, рассчитывают по формуле:
| σ = Р + τSin | а | |
| α | ||
| 2 |
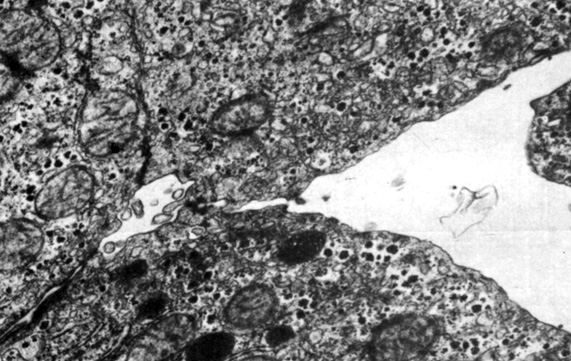
Рис. 17. Расхождение контактных поверхностей гепатоцитов при повышении гидростатического давления в кровеносном русле печени. 5-я минута действия давления 66 гПа. Увеличение 17 000
где Р - гидростатическое давление; σ - касательное напряжение, действующее в плоскости мембраны; α - угол между разошедшимися плазмолеммами.
При постоянном давлении Р большему значению угла а (0° ≤ а ≤ 180°) соответствует большее значение напряжения σ, если τ не убывает при росте α. Поэтому по величине угла α можно судить о механических свойствах сохранившегося в его вершине соединения. Изменение структуры контакта в данном случае обусловлено действием только механического фактора - гидростатического давления, так как известно, что длительная (до 1,5 ч) перфузия изотонической жидкостью при физиологическом давлении не изменяет ультраструктуру контактов гепатоцитов (Ю. П. Черненко, 1975, и др.).
В методах второй группы общим тестом на агрегационную способность клеток в суспензионной культуре является факт установления контакта клеток в относительно слабом силовом (механическом) поле. Механическое воздействие на клетки и агрегаты увеличивает частоту встреч клеток и "испытывает" на прочность образовавшиеся агрегаты.
A. A. Moscona (1974) вращал сосуд с суспензией клеток и исследовал динамику образования агрегатов. A. S. G. Gurtis (1973) оценивал долю столкновений, приводящих к стабильному контакту клеток в ламинарном потоке жидкости. Ряд авторов определяют процент слипшихся клеток во встряхиваемой (P. Henkart и др., 1974) или медленно вращающейся суспензии (J. J. Deman, E. A. Bruyneel, 1974). S. A. Roth, I. A. Weston (1967) встряхивали суспензию меченых клеток и агрегатов немеченых клеток. Количество меченых клеток, прилипших к агрегатам, служит показателем агрегационной способности.
Дополнительную информацию об адгезивных свойствах получают при оценке способности клеток прилипать к субстрату и оценке прочности прикрепления к субстрату с помощью отрыва струей жидкости, центробежной силой или встряхиванием.
Изменение механических свойств контактов тканевых клеток при патологических процессах. К настоящему времени накоплено много экспериментальных данных об изменении адгезивных свойств клеток при патологических процессах (Ю. М. Васильев, А. Г. Маленков, 1968; А. Г. Маленков, 1974, 1976). С помощью методов D. R. Coman и количественного диспергирования показано, что клетки различных опухолей обладают меньшей сцепленностью по сравнению с нормой (D. R. Coman, 1944; А. Г. Маленков, 1976). В медленнорастущих гепатомах сцепленность клеток такая же, как и в контроле. Однако инкубация кусочков ткани в среде без Са2+ приводит к большему выходу клеток при диспергировании у гепатом (Е. А. Модянова, 1970). Этот эффект менее выражен при добавлении в среду инкубации бескальциевого перфузата, полученного из нормальной печени. У быстрорастущих гепатом появляется фракция стабильно изолированных клеток (с меньшей прочностью сцепления). При этом бескальциевый перфузат не восстанавливает прочности МК (E. A. Modjanova, A. G. Malenkov, 1973). У асцитной гепатомы формируются слабосвязанные друг с другом комплексы. Клетки в них образуют высокопрочные контакты. Сравнение адгезивных свойств клеток различных штаммов гепатом позволяет выделить три стадии опухолевой прогрессии, отличающиеся стабильностью контакта и обратимостью механических свойств при действии АФ (E. A. Modjanova, A. G. Malenkov, 1973).
Устойчивость ткани к совместному действию дефицита ионов Са2+ и механического диспергирования понижена у мышей тех линий, которые имеют высокую частоту спонтанных опухолей (В. И. Левенталь, 1976). Е. А. Модянова (1973) выявила корреляцию между прочностью сцепления клеток легкого у мышей разных линий и их предрасположенностью к индукции опухолей легких уретаном. Автор считает, что предрасположенность к опухолям легких у мышей определяется прочностью межклеточных связей.
Мы исследовали механические свойства ультраструктурных элементов контакта гепатоцитов у мышей линий С57В1 и СВА. При нагнетании изотонической жидкости в кровеносное русло печени животных отмечено следующее. У мышей линии С57В1 давление 40 гПа, действующее в течение 10 с, вызывает неравномерное расхождение мембран простого соединения. Области расхождения часто прерываются участками простых соединений различной протяженности (от 0,05 мкм до 1 мкм, рис. 18, а). На 20 мкм контура освободившейся клеточной поверхности приходится 20,5 ± 3,7 сохраненных участков простых соединений. Эти участки могут находиться один от другого на малом расстоянии, образуя цепи (см. рис. 18, а). Угол между плазмолеммами соседних клеток сохранившихся участков простых соединений составляет 55,3° ± 8,0°. Давление 26 гПа, действующее в течение 60 с, вызывает появление широких межклеточных щелей в области простых соединений, которые местами прерываются сохраненными участками контакта (рис. 18, б).
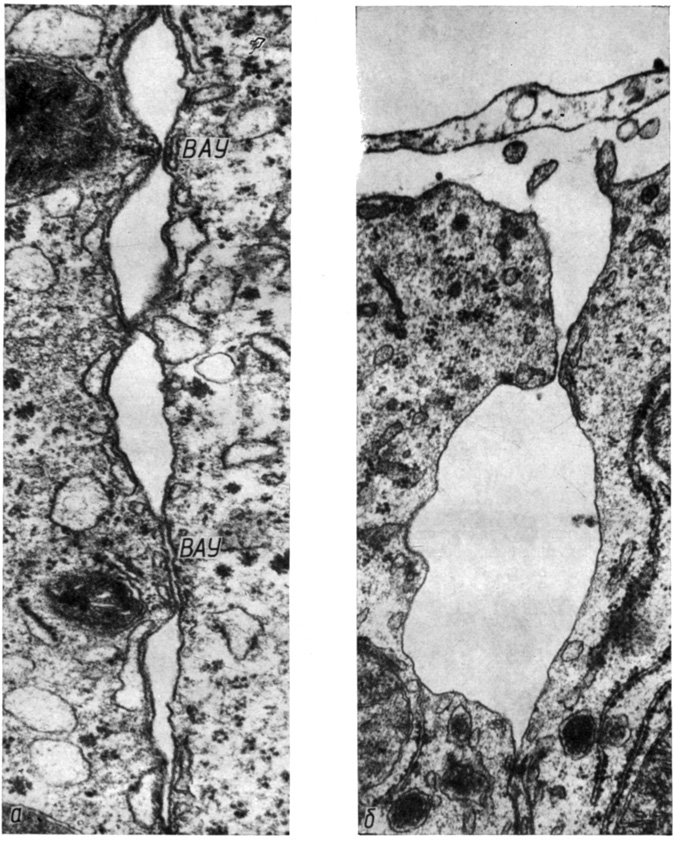
Рис. 18. Разрушение простого соединения гепатоцитов у мышей линии С57В1 при повышенном давлении в кровеносном русле печени: а - высокоадгезивные участки (ВАУ) простого соединения при действии давления 40 гПа в течение 10 с, б - широкая межклеточная щель в области бывшего простого соединения гепатоцитов при действии давления 26 гПа в течение 60 с. Увеличение: а - 52 000, б - 40 000
У мышей линии СБА давление 40 гПа, действуя в течение 10 с, вызывает более равномерное расхождение поверхностей гепатоцитов в области простых соединений (рис. 19, а). На 20 мкм контура разошедшихся поверхностей гепатоцитов в области простых соединений приходится 6,4 ± 2,1 (Р < 0,001) их сохранившихся участков. Угол, образованный мембранами соседних клеток в месте перехода сохраненного простого соединения в разрушенное, составляет 29,2° ± 5,1° (Р < 0,001). Давление 26 гПа, действуя в течение 60 с, вызывает у мышей линии СВА появление широких межклеточных щелей без высокоадгезивных перемычек в простом соединении (рис. 19, б).
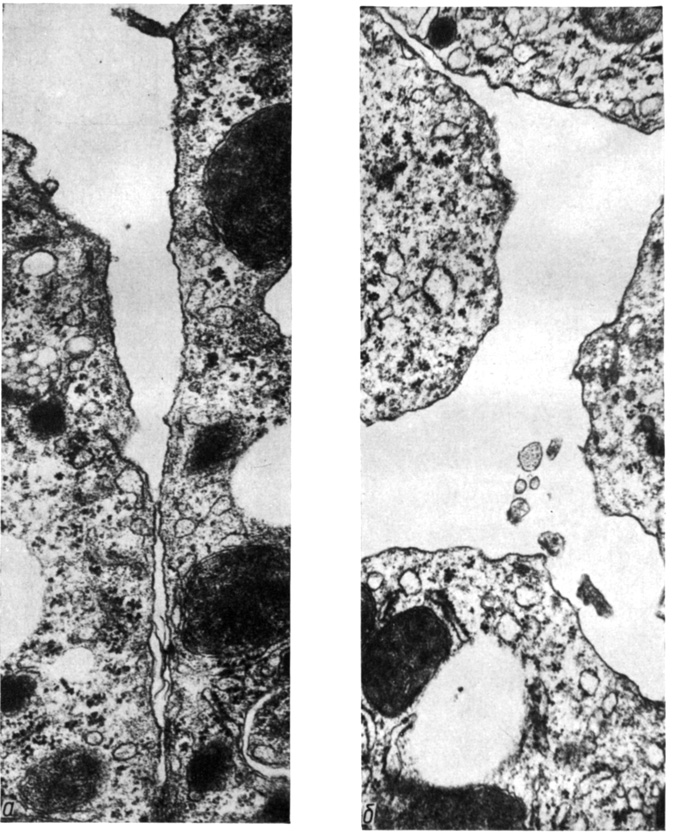
Рис. 19. Разрушение простого соединения гепатоцитов у мышей линии СВА при повышенном давлении в кровеносном русле печени: а - равномерное расхождение контактных поверхностей гепатоцитов при действии давления 26 гПа в течение 60 с. Увеличение: а - 42 000, б - 35 000
Следовательно, простое соединение гепатоцитов у мышей линии СВА обладает меньшей адгезивной прочностью, чем у мышей линии С57В1, вследствие меньшего числа и пониженных адгезивных свойств ВАУ простого соединения. Мы назвали ВАУ те участки простого соединения, которые сохраняются при действии нагрузки, разрушающей контакт, когда окружающая область простого соединения уже разрушена (см. рис. 18). Так как у мышей линии СВА частота появления опухолей больше, чем у мышей линии С57В1 (Е. А. Модянова, 1973), предрасположенность к опухолям может быть связана с различиями адгезивных свойств клеточной поверхности в области простого соединения. Степень неоднородности адгезивных свойств простого соединения, вероятно, генетически предопределена, поскольку у мышей разных линий соотношение высокоадгезивных и низкоадгезивных областей различно.
Метод жидкостной дезинтеграции ткани позволил обнаружить, что выход эпителиоцитов изменяется: в процессе метаморфоза амфибий (Л. В. Гербильский, Г. А. Чуич, 1970), при образовании стрессорных язв (Н. А. Чуич, 1975), изменении уровня гормонов в крови животных (Г. А. Чуич, 1970; В. М. Пинская, 1975; Ю. П. Черненко и др., 1973; В. П. Колотенко, 1977). Это свидетельствует о том, что механические свойства МК подвержены гормональной регуляции.
Физико-химическая природа адгезивной связи клеток. Современные представления о физико-химической природе адгезии клеток отражены в гипотезах, касающихся разных объектов (культура клеток губок, эмбрионов птиц и млекопитающих, дефинитивные ткани животных) и различных процессов (узнавание, агрегация, сортировка клеток, разрушение контакта в культуре клеток и ткани).
Выделение из культуральной среды видо- и тканеспецифических веществ, усиливающих агрегацию клеток в культуре, обусловило появление гипотезы (A. A. Moscona, 1974) о "клеточных лигандах". Термином "лиганды" обозначают белково-углеводные комплексы, которые функционируют по типу поверхностных рецепторов клетки и определяют специфическую адгезию при агрегации. Гипотеза подтверждается следующими фактами. Полное подавление синтеза белков и понижение температуры угнетают обратимо гистотипическую агрегацию свежедиссоциированных трипсином клеток эмбриона (М. Н. Moscona, A. A. Moscona, 1966). Восстановление клеточной адгезивности совпадает с появлением на поверхности клеток материала, окрашиваемого рутениевым красным (A. A. Moscona, 1974). С другой стороны, подавление синтеза гликопротеинов останавливает реагрегацию клеток куриного эмбриона (R. E. Hausman, A. A. Moscona, 1973). Фактор агрегации губок представляет собой протеогликановый комплекс с уникальными физико-химическими свойствами, зависящими от содержания ионов Са2+ (P. Henkart и др., 1973). Активность фактора агрегации клеток сетчатки куриного эмбриона связана с белково-углеводным комплексом, образующим одну линию при электрофорезе в полиакриламидном геле (R. E. Hausman, A. A. Moscona, 1973). Выделен рецептор агрегации из клеточной поверхности губки (W. E. G. Mtiller и др., 1976). Из мембранной фракции сетчатки и головного мозга куриных эмбрионов экстрагированы тканеспецифические факторы, усиливающие реагрегацию суспендированных клеток (R. E. Hausman и др., 1976). Диализат гомогената печени куриных эмбрионов и взрослых птиц обладает активностью фактора, ускоряющего агрегацию (L. Sankaran, B. M. Pogell, 1976). Гипотеза A. A. Moscona (1974) подчеркивает участие гликопротеинов клеточной поверхности в агрегации клеток, но не объясняет природу связывания клеток с помощью данных молекул.
Следующий вклад в этом направлении делает S. Rosernan (1974), вводя представление об агрегации клеток путем фермент - субстратного связывания. В качестве ферментов предложены гликозилтрансферазы, субстратов - недостроенные углеводы клеточной поверхности. Автор полагает, что гипотеза может объяснить участие сложных углеводов в клеточной адгезии и способность клеток при дифференциации устанавливать и разрушать адгезивную связь. Гипотезу подтверждают следующие экспериментальные данные: изолированные клетки сетчатки куриного эмбриона могут переносить сахара на экзогенные гликопротеиновые акцепторы (S. Roth, 1973); плазмолеммы клеток печени крысы и культуральных фибробластов обладают гликозилтрансферазной активностью (W. D. Merrit и др., 1977; J. T. La Mont и др., 1977); из фактооа агрегации губок выделена сиалилтрансфераза (W. Е. Miiller и др., 1977); уменьшение агрегационной способности клеток сетчатки куриного эмбриона со-провождается снижением активности гликозилтрансферазы (R. L. Hoover, 1977).
Из тканей печени и легкого взрослых мышей выделен тканеспецифический АФ, который представляет собой макромолекулярную фракцию бескальциевого солевого экстракта органа, полученную из жидкости, прошедшей через орган при перфузии (А. Г. Маленков, Е. А. Модянова, 1970), или той, в которой инкубировали кусочки ткани (В. П. Ямскова, 1977). АФ является углеводосодержащим белком (В. П. Ямскова и др., 1977). Это вещество уменьшает выход клеток при диспергировании ткани, предварительно инкубированной в бескальциевой среде (А. Г. Маленков, 1974), повышает силу сцепления и изменяет механические свойства простого соединения гепатоцитов у мышей линии СБА (Е. А. Модянова, 1974; А. Г. Маленков и др., 1979), повышает устойчивость ткани к совместному действию диспергирования и дефицита ионов Са2+ у минимальных гепатом (E. A. Modjanova, A. G. Malenkov, 1973). Действие АФ тканеспецифично (E. A. Modjanova, A. G. Malenkov, 1973; В. П. Ямскова и др., 1977).
Существование фактора, стимулирующего агрегацию клеток губок и эмбрионов, и АФ, изменяющего механические свойства МК у взрослых животных, создает предоставление о межклеточном цементе - гипотетическом веществе, склеивающем клетки (А. Г. Маленков, 1974). В рамки представления о межклеточном цементе укладывается: участие сложных углеводов и белков в различных видах клеточной адгезии (A. A. Moscona, 1974; P. Pippia и др., 1980), действие ряда ферментов на диспергируемость тканей (Р. О. Seglen, 1973; В. L. Obrink и др., 1977) и присутствие на поверхности клеток углеводной шубы (С. P. Leblond, 1967), малый вклад дальнодействующих ван-дер-ваальсовых сил в общую силу сцепления тканевых клеток (E. A. Modjanova, A. G. Malenkov, 1973), а также видоспецифическая стимуляция агрегации клеток фракциями плазмолемм (В. L. Obrink и др., 1977).
Агенты, разрушающие микрофиламенты и микротрубочки, изменяют адгезивные свойства клеток при агрегации (J. V. George, К. V. Rao, 1975; J. Overton, 1977) и прилипании к субстрату (R. V. Juliano, Е. Galagang, 1977). Это позволяет предположить участие контрактильной и скелетной систем клетки в адгезии. В. J. Jones (1975) предложил модель, в которой сокращение контрактивных белков клеточной поверхности вызывает изменение положения углеводной части гликопротеинов, уменьшая или увеличивая количество связей с подобными молекулами соседней клетки. Подвижность специализированных компонентов клеточной поверхности может играть роль в агрегации, так как в процессе ее наблюдают перераспределение частиц, обнаруживаемых на сколах мембран (J. H. Gregg, H. C. Aldrich, 1972), и цитохалазин В приводит к дезагрегации внутримембранных частиц (R. E. Scott и др., 1977). Кроме того, фактор агрегации клеток (сетчатки куриного эмбриона) изменяет подвижность рецептора конканавалина A (J. McDonough, J. Lilien, 1975). В свою очередь, кластирование рецепторов конканавалина А сопровождается накоплением подмембранных микрофиламентов (D. A. Albertini, E. Anderson, 1977).
Присутствие РНК в клеточной поверхности и изменение адгезивной способности клеток при действии РНК-азы послужило основанием для гипотезы о специфической адгезии клеток путем сшивания водородными связями полинуклеотидных цепей, рас-положенных на поверхностях соседних клеток (E. Mayhew, 1974). РНК и ДНК вызывают усиление агглютинации эритроцитов (A. Pugliese и др., 1976).
Полагают, что регулятором хемотаксиса в начальной стадии агрегации клеток Dictyostelium discoideuin служит циклический АМФ, периодически испускаемый определенными клетками - водителями ритма (W. Roos, G. Gerisch, 1976).
Имеются чисто физические гипотезы адгезивной связи клеток. A. S. G. Curtis (1973) считает, что адгезивное взаимодействие клеток определяется соотношением дальнодействующих ван-дер-ваальсовых сил притяжения и электростатических сил отталкивания. Согласно этой гипотезе, существует два минимума потенциальной энергии взаимодействия клеток. Наблюдаемое в простом соединении расстояние 10-20 нм между плазмолеммами клеток согласуется со вторым минимумом потенциальной энергии в теории A. S. G. Curtis (1973). При взаимодействии фиксированных эритроцитов с металлическим электродом наблюдаются два минимума потенциальной энергии взаимодействия клеток с субстратом (D. Gingell, J. A. Fornes, 1975). Использование коллоидного Fe в качестве маркера анионных групп позволило установить, что плотность заряда на поверхности одной клетки минимальна в участке, находящемся напротив микровыроста соседней клетки в суспендированной культуре. Это предполагает существенность распределения электрического заряда на поверхности клеток при установлении контакта (L. Weiss и др., 1975). Усиление агглютинации клеток с помощью молекул только определенной длины говорит о существовании дальнодействующих сил отталкивания (J. J. Deman, E. A. Bruyneel, 1974). A. S. G. Curtis (1973) объясняет специфичность адгезии различием временных зависимостей адгезивных свойств клеток.
К чисто физическим следует отнести также единую гипотезу, основанную на моделировании клетки заряженной каплей жидкости с вязкоэластической мембраной (К. Dolowy, 1975), и энергетическую гипотезу (M. S. Steinbreg, 1964), по которой сортировка клеток в гетеротопических агрегатах приводит к распределению, соответствующему минимуму потенциальной энергии взаимодействия всей системы клеток.
Под действием механической нагрузки клеточная поверхность ведет себя как сложное вязкоупругое тело, которое может быть представлено реологическими моделями с упругими и вязкими элементами (A. R. Williams, 1973). Вязкоупругие свойства клеточной поверхности зависят от температуры (J. M. Mitchison, M. M. Swann, 1954), присутствия ионов Са2+ (L. Weiss, 1967), возраста клеток (M. A. Lichtman, 1970), уровня АТФ (R. J. Weed и др., 1969). Реологические свойства клеточной поверхности должны играть существенную роль в клеточной адгезии, что подтверждается зависимостью порогового значения силы, разрушающей МК, от длительности приложения нагрузки (А. Г. Меликянц и др., 1977), влиянием степени насыщенности жирных кислот мембранных липидов на агрегацию (A. S. G. Curtis и др., 1975) и корреляцией между изменением мембранной текучести и прикреплением клеток к подложке при охлаждении (M. J. Ueda и др., 1976).
Рассмотренные выше гипотезы адгезивной связи клеток относятся к контакту клеток в целом. В то же время МК в большинстве клеточных систем представляет собой сложноорганизованную систему различных клеточных соединений - простого, плотного, щелевого и др. Поэтому следующим шагов в развитии представления о клеточной адгезии должно быть изучение механических свойств отдельных клеточных соединений.
Механические свойства ультраструктурных элементов МК. Сведения о механических свойствах отдельных соединений основаны на косвенных данных об изменении их числа в различных биологических процессах (J. Overton, 1977) и механическом диспергировании тканей (D. A. Goodenough, 1974). Мы провели сравнительную оценку механических свойств соединений гепатоцитов при действии напряжения, разрывающего соединение. В опытах использовали самцов белых беспородных крыс массой 150-170 г. Исследовали динамику разрушения контактов гепатоцитов при нагнетании в кровеносное русло печени раствора Хенкса (рН 7,4) под давлением 66 и 130 гПа при 37° С в течение 1,5 или 10 мин (В. Ф. Ушаков, 1977; В. Ф. Ушаков, Ю. П. Черненко, 1978). Кроме того, у интактных животных определяли часть контактной поверхности гепатоцита, которую в среднем занимает каждый тип соединений, участвующих в образовании МК.
Обнаружены следующие особенности механических свойств соединений гепатоцитов. Простое соединение занимает 78,6% контактной поверхности клеток и обладает неоднородными адгезивными свойствами. На низкоадгезивной контактной поверхности в области простого соединения расположены ВАУ различной протяженности (от 0,05 до 1 мкм, рис. 20, а). Угол между плазмолеммами в месте перехода разрушенного простого соединения в ВАУ достигает 90°. ВАУ в простом соединении гепатоцитов выявлены нами и у мышей линий СВА и С57В1. В процессе эмбрионального и постнатального развития (J. P. Trinkaus, L. L. Lentz, 1967; P. Stanka, 1975), а также при агрегации клеток в культуре (С. W. Evans, P. B. Bergquist, 1974; E. J. Sanders, S. E. Zalik, 1976) наблюдают участки простых соединений, локально соединяющих клетки. У клеток эмбрионов и в культуре специализированные адгезивные структуры могут отсутствовать. Из этого следует, что такие участки простых соединений, вероятно, используются клетками для регуляции адгезивной связи в процессе установления контакта. Можно предположить, что ВАУ в простом соединении взрослых животных служат также для регуляции лабильной адгезивной связи клеток. Возможно, что ВАУ в простом соединении гепатоцитов соответствуют одному из промежуточных этапов формирования соединений слипания (десмосом или зон слипания).
Во всех случаях сохраненного простого соединения при действии разрывающего усилия между плазмолеммами гепатоцитов находится материал с низкой электронной плотностью, который исчезает при расхождении клеточных поверхностей на 30-35 нм (см. рис. 18, 20, а). Следовательно, участки простого соединения могут противодействовать усилию, разрывающему соединение, только в присутствии внешнего слоя клеточной поверхности. Такой вывод эквивалентен утверждению: надмембранный компонент в области простого соединения выполняет роль межклеточного цемента. Простое соединение разрушается без нарушения целостности плазмолеммы.
Соединение типа "замка" занимает 7,6% контактной поверхности гепатоцитов и обладает малой механической прочностью, поскольку оно не обнаруживается при действии разрывающего напряжения. Таким образом, это соединение не несет специфической адгезивной функции. Можно предположить, что вероятными функциями соединения типа "замка" являются увеличение площади контактной поверхности или участие в согласованном волновом движении поверхностей контактирующих клеток (В. Ф. Ушаков, 1977). Подтверждением последней возможности служат наличие подмембранного компонента в простом соединении гепатоцитов, представленного микрофиламентами (В. И. Архипенко к др., 1975; В. Ф. Ушаков, 1980), и доказательство актомиозиновой природы подповерхностных микрофиламентов в различных немышечных клетках (H. E. Huxley, 1973; M. N. Malik, A. Stracher, 1977; M. S. Mooseker и др., 1980).
Десмосомы занимают наименьшую часть контактной поверхности гепатоцитов (1,8%) и обладают прочностью сцепления, сравнимой с адгезивной прочностью ВАУ простого соединения, поскольку они разрушаются без нарушения целостности плазмолеммы (Г. А. Чуич и др., 1979; В. Ф. Ушаков, 1980) и угол между плазмолеммами вблизи десмосом не превышает 90° (рис. 20, б).
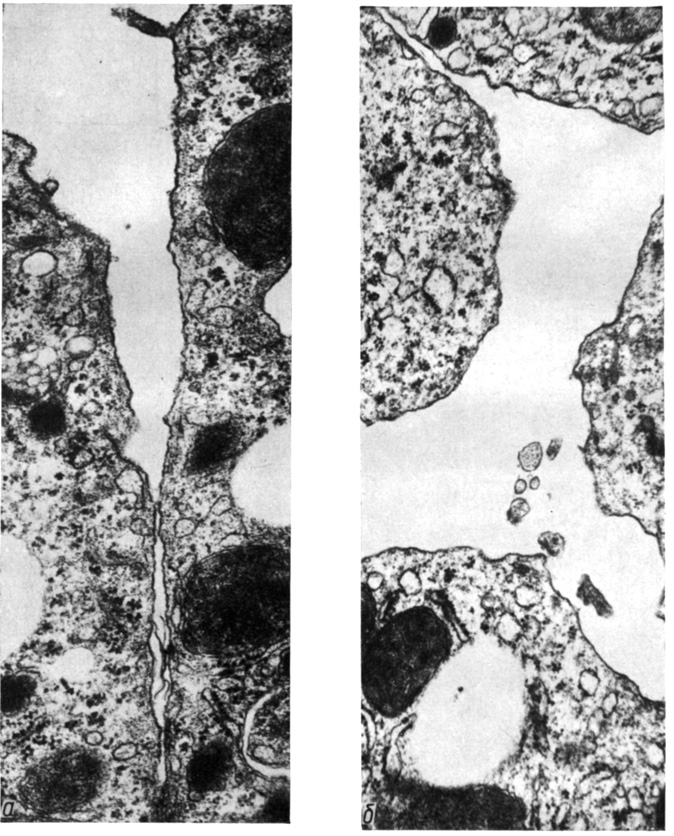
Рис. 20. Разрушение контакта гепатоцитов крыс при действии давления 66 гПа в течение 5 мин: а - высокоадгезивные участки (ВАУ) в простом соединении, б - десмосома (Д) при действии повышенного давления. Угол между разошедшимися поверхностями вблизи десмосомы не превышает 90°. Увеличение: а - 40 000, б - 50 000
Десмосомы относят к специализированным адгезивным структурам (N. S. McNutt, R. S. Weinstein, 1973; J. Overton, 1974). Считают, что совместно с тонофиламентами они образуют цитоскелет, функцией которого является распределение пассивной механической нагрузки в ткани (D. E. Kelly, 1966; A. G. Matoltsy, 1975). В отличие от простого соединения в области десмосом механическая связь клеточных поверхностей, вероятно, осуществляется с помощью специальных микрофиламентов, так как средняя часть межклеточного промежутка в области десмосомы представлена микрофиламентами диаметром 3-4 нм, которые могут продолжаться вплоть до плазмолемм. Кроме того, на сколах, перпендикулярных плазомолеммам, средняя часть промежутка гранулярна и связана тонкими мостиками с мембранами клеток (L. A. Staehelin, 1974).
Зона слипания занимает 3,8% контактной поверхности гепатоцитов. В тех случаях, когда область разрушения контакта под действием разрывающего усилия приближается к желчным канальцам (5, 10 мин действия 66 и 130 гПа), угол между плазмолеммами соседних гепатоцитов вблизи зон слипания достигает 180° (рис. 21, а). Это, вероятно, означает, что механическая прочность межклеточного промежутка в области зоны слипания выше, чем в простом соединении и десмосомах. Полагают, что функцией зоны слипания является кооперация активных механических усилий, генерируемых сократительными системами отдельных клеток (L. A. Staehelin, 1974). Подтверждением этому служит доказательство актиновой природы подмембранных филаментов зоны слипания диаметром 7 нм (М. S. Moosaker, 1976) и сокращение изолированной щеточной каемки эпителия тонкой кишки в присутствии АТФ (R. Rodewald и др., 1976).
Плотное соединение занимает 3,8% контактной поверхности гепатоцитов и обладает высокой механической прочностью, поскольку при действии разрывающего усилия оно не разрушается и угол между плазмолеммами вблизи него достигает 180° (рис. 21, б). Кроме того, при жидкостной дезинтеграции печени мы наблюдали разрывы клеточной поверхности вблизи плотных соединений (см. рис. 16). Следовательно, связь мембран в плотном соединении в этом случае прочнее плазмолеммы клетки. Такая прочная связь возможна благодаря сети точечных слияний наружных листков мембран соседних клеток в области плотного соединения. Точечные слияния, вероятно, осуществляются с помощью белковых (или белково-липидных) фибрилл, расположенных в плоскости мембран (L. A. Staehelin, 1974). Гипертонические растворы дисахаридов и мочевины расщепляют плотное соединение (D. B. DiBona, M. M. Civan, 1973; D. A. Goodenough, N. B. Gilula, 1974). B. E. Hull, L. A. Staehelin (1976) обнаружили, что форма сети точечных слияний плотного соединения сильно изменяется при действии механической нагрузки на эпителиальный пласт. Они предложили гипотезу, по которой геометрическая организация сети точечных слияний плотного соединения определяется характером механических напряжений, существующих в ткани.
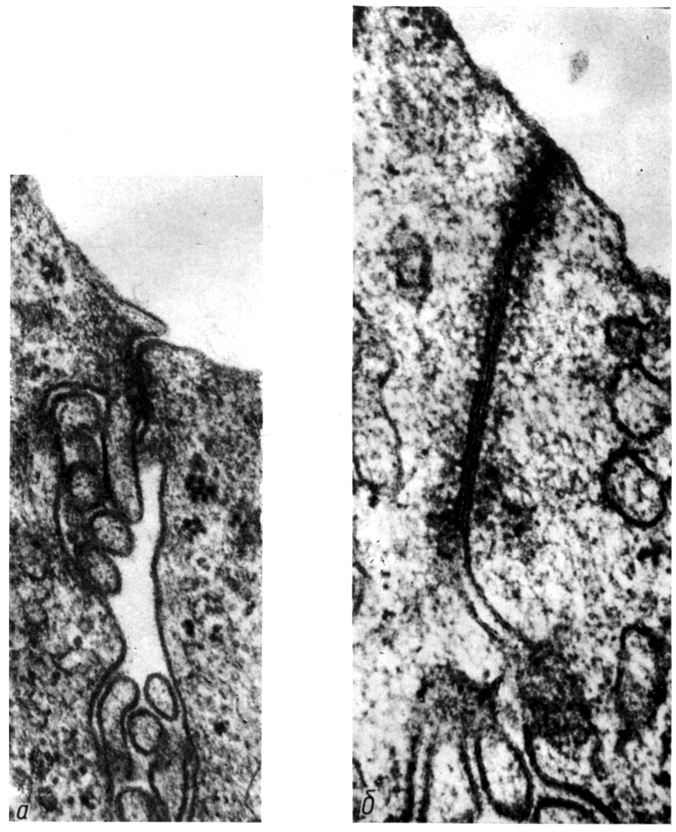
Рис. 21. Зона слипания (а) и плотное соединение (б) при действии разрывающего усилия (130 гПа, 5 мин). Угол плазмолеммами вблизи соединения достигает 180°. Увеличение: а - 98 000
Щелевое соединение занимает 5,1% контактной поверхности гепатоцита. Оно не разрушается при действии разрывающего усилия, поскольку механическая связь клеточных поверхностей в нем прочнее плазмолеммы (рис. 22). Это согласуется с получением фракций плазмолемм, богатых щелевыми соединениями, при гомогенизации ткани с последующей обработкой детергентами (R. J. Nicholson и др., 1980). Щелевое соединение можно расщепить вдоль средней линии при перфузии печени гипертоническими растворами дисахаридов (D. A. Goodenough, N. B. Gilula, 1974). Механическая связь мембран в области щелевого соединения осуществляется с помощью белковых субъединиц - коннексонов, входящих в состав обеих мембран (D. A. Goodenough, 1976; С. Peracchia, 1977). При разрушении щелевого соединения ультразвуком выявлены две белковые фракции, которые названы соединительными белками - веществами, участвующими в межклеточной связи (D. A. Goodenough, 1974).
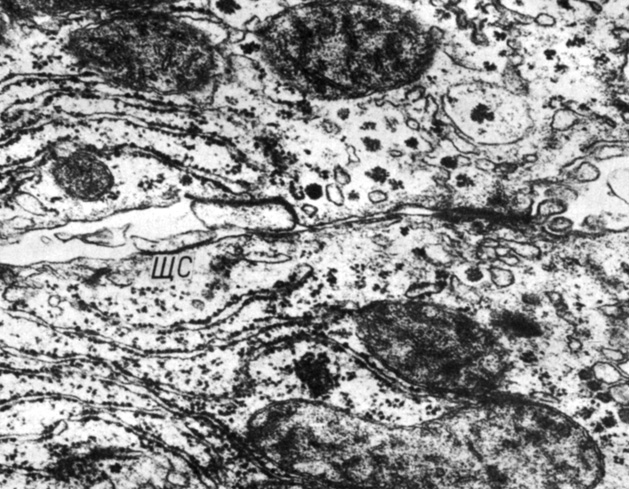
Рис. 22. Щелевое соединение (ЩС) при действии повышенного гидростатического давления в кровеносном русле печени (66 гПа, 5 мин). Увеличение 30 000
На основании изложенного соединения гепатоцитов можно расположить в следующий ряд по возрастанию адгезивной прочности*: низкоадгезивная часть простого соединения и соединение типа "замка", ВАУ простого соединения и десмосомы, зоны слипания, щелевые и плотные соединения. Различие адгезивных свойств обусловлено разнообразием в способах механического связывания мембран в отдельных соединениях. В простом соединении и соединении типа "замка" механическая связь осуществляется с помощью материала низкой электронной плотности, образованного слившимися гликокаликсами соседних клеток и обладающего свойствами межклеточного цемента. В Десмосомах плазмолеммы связаны с помощью материала, имеющего микрофиламентозную структуру. В щелевом соединении клеточные поверхности связаны гексагонально упакованными в плоскости мембран белковыми глобулами. Прочная механическая связь в плотном соединении обеспечивается динамичной сетью точечных слияний наружных листков мембран. Пока остается неясным соответствие гипотез межклеточной связи и механических свойств отдельных клеточных соединений, поскольку существуют лишь фрагментарные сведения о химической структуре соединений и не исследовано влияние физико-химических факторов на механические свойства отдельных соединений.
* (Под адгезивной прочностью мы понимаем максимальное разрывающее напряжение, которое может выдержать соединение, не разрушаясь.)
Влияние физико-химических факторов на механические свойства МК. Большое количество гипотез, объясняющих адгезивные свойства клеток, отражает неоднозначность трактовки экспериментальных результатов. Так, например, удаление сиаловой кислоты с клеточной поверхности приводит к увеличению адгезии клеток при реагрегации (J. J. Deman, E. A. Bruyneel, 1974). Это объясняют уменьшением электростатического отталкивания клеток (A. S. G. Gurtis, 1973), увеличением числа акцепторов для гликозилтрансфераз (C. W. Lloyd, G. M. W. Cook, 1974) или изменением жесткости молекул гликопротеинов (J. J. Deman и др., 1974).
Снижение температуры подавляет агрегацию клеток (A. A. Moscona, 1974; J. V. George, K. V. Rao, 1975), препятствует агглютинации культуральных клеток конканавалином А (S. B. Oppenheimer, J. Odencrantz, 1972) и прикреплению к субстрату (R. J. Juliano, E. Galagang, 1977), уменьшает выход клеток при диспергировании ткани (Е. А. Модянова, 1970; В. И. Левенталь, 1976). Это может быть обусловлено изменением реологических свойств клеточной поверхности, понижением латеральной подвижности ее компонентов (А. Г. Маленков, 1974), изменением физико-химических свойств межклеточного цемента или синтеза его компонентов (A. A. Moscona, 1974).
Мы исследовали изменение механических свойств контактов гепатоцитов при понижении температуры на ультраструктурном уровне (В. Ф. Ушаков, 1977). Нагнетание охлажденного до 4°С раствора Хенкса в кровеносное русло печени крыс под давлением 66 гПа в течение 1 и 5 мин вызывает следующие изменения в ультраструктуре гепатоцитов и их контактов по сравнению с контролем (контролем служила печень, в кровеносное русло которой нагнетали раствор Хенкса при температуре 37° С). В сильно обводненной гиалоплазме расположены островки, образованные цистернами цитоплазматической сети и митохондриями (рис. 23,а). Размеры желчных канальцев увеличены. Уменьшено число микроворсинок в них. Хорошо выражен подмембранный компонент клеточной поверхности толщиной до 200 нм. Уменьшены размеры подповерхностных вакуолей. На месте простого соединения уже на 1-й минуте действия повышенного давления образовались широкие межклеточные щели шириной до 500 нм с электроннопрозрачным содержимым (см. рис. 23,а). Это указывает на снижение адгезивных свойств клеточных поверхностей в области простого соединения. Десмосомы, зоны слипания, щелевые и плотные соединения сохранены. Наблюдаются многочисленные разрывы плазмолеммы клеток (рис. 23,б). Таким образом, охлаждение печени до 4° С вызывает снижение адгезивных свойств клеточных поверхностей в области простого соединения и прочности клеточной поверхности.
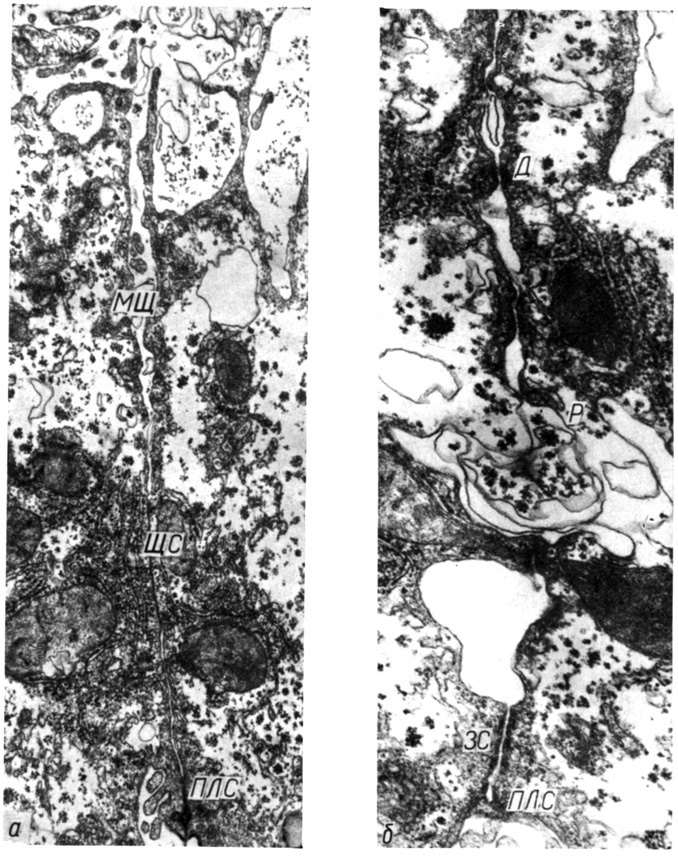
Рис. 23. Ультраструктура контактов гепатоцитов при нагнетании охлажденного до 4°С раствора Хенкса в кровеносное русло печени. Давление раствора 66 гПа: а - 1 мин охлаждения, гиалоплазма гепатоцитов обводнена, видна широкая межклеточная щель (МЩ) в области бывшего простого соединения, ЩС - щелевое соединение, ПЛС - плотное соединение; б - 5 мин охлаждения, десмосома (Д), зона слипания (ЗС) и плотное соединение (ПЛС) сохранены, Р - разрыв клеточной поверхности. Увеличение: а - 16 000, б - 40 000
Влияние ионов Ca2+ на агрегационную способность клеток (A. A. Moscona, 1974; J. J. Deman и др., 1974), выход клеток при диспергировании ткани (P. O. Seglen, 1973; В. И. Левенталь, 1976; А. Г. Меликянц, 1976) и морфологию контакта (Ю. П. Черненко, 1975) объясняют гипотезой о кальциевых мостиках или изменением физического состояния межклеточного цемента (P. Henkart и др., 1973), уменьшением электростатического отталкивания клеток (A. S. G. Curtis, 1973), изменением реологических свойств клеточной поверхности (L. Weiss, 1967), поперечным сшиванием полисахаридов в глубоких слоях клеточной шубы (J. J. Deman и др., 1974) или изменением свойств цитоскелета (J. J. Rosen, L. A. Calp, 1977). Участие Ca в проявлении механических свойств разных клеточных соединений, вероятно, неодинаково.
Мы исследовали ультраструктуру контактов гепатоцитов при нагнетании в кровеносное русло печени крыс раствора Хенкса, содержащего 0,003 моль ЭДТА, под давлением 66 г Па в течение 1 и 5 мин (В. Ф. Ушаков, 1977). ЭДТА выбран в качестве агента, активно связывающего ионы Ca2+. В отличие от контроля (нагнетание раствора Хенкса) уже в начале действия повышенного давления появляются межклеточные щели шириной до 500 нм (рис. 24), изредка прерываемые щелевыми соединениями, десмосомами и ВАУ простых соединений (рис. 25, 26). При этом?
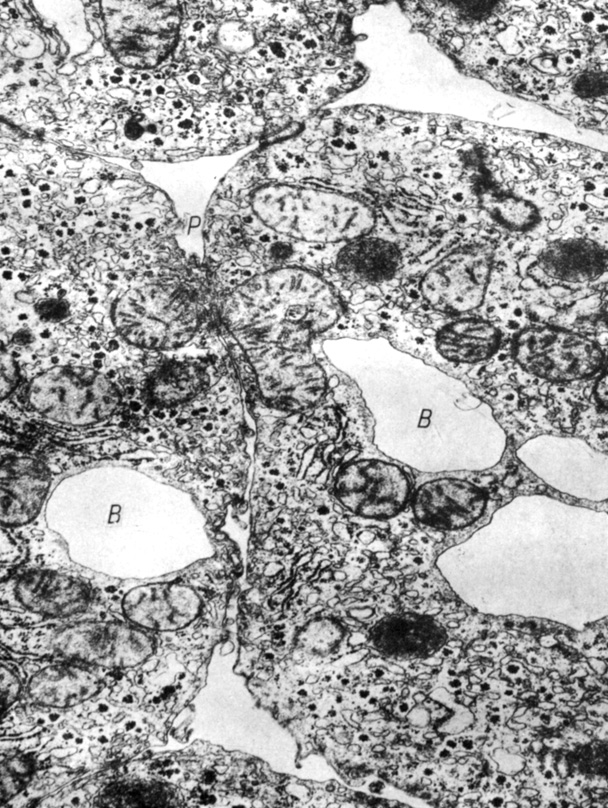
Рис. 24. Широкие межклеточные щели в области бывшего простого соединения при дефиците ионов Са2+. В кровеносное русло печени нагнетали раствор Хенкса, содержащий 0,003 моль ЭДТА, под давлением 66 гПа в течение 1 мин, В - впячивание поверхности гепатоцита, Р - разрыв плазмолеммы. Увеличение 30 000
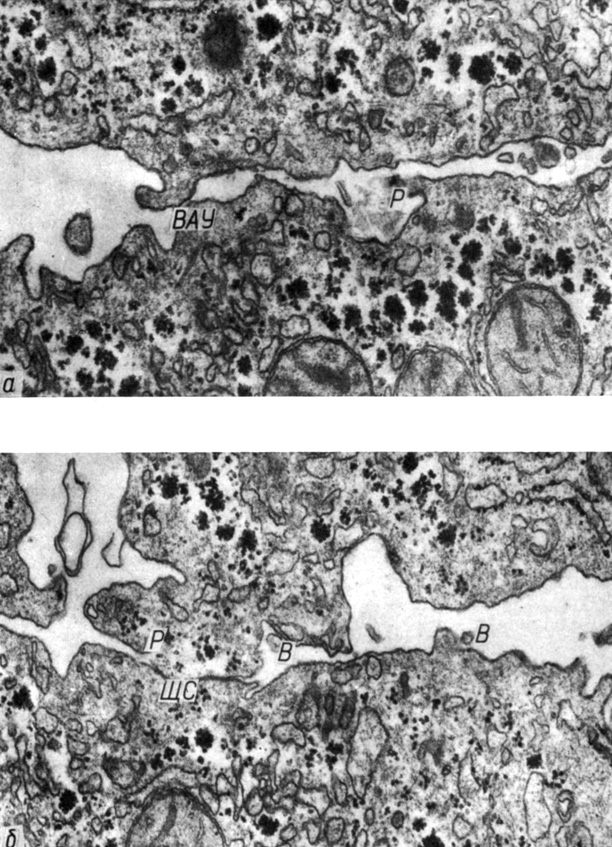
Рис. 25. Высокоадгезивный участок (а) и щелевое соединение (б) при дефиците ионов Са2+ во внеклеточной среде. Нагнетание раствора Хенкса, содержащего 0,003 моль ЭДТА, под давлением 66 гПа в течение 1 мин; ВАУ - высокоадгезивный участок простого соединения, ЩС - щелевое соединение, Р - разрыв плазмолеммы, В - везикула. Увеличение а - 48 000, б - 42 000
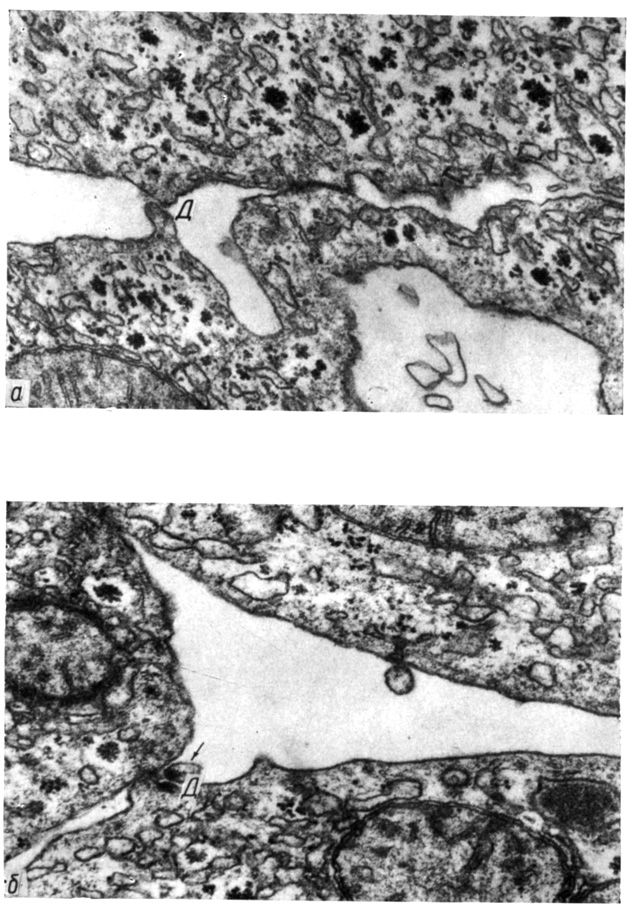
Рис. 26. Десмосома (Д) при дефиците ионов Са2+ во внеклеточной среде. Нагнетание раствора Хенкса, содержащего 0,003 моль ЭДТА, под давлением 66 гПа в течение 1 мин (а) или 5 мин (б). Стрелкой указана оторванная полудесмосома. Увеличение 42 000
угол между мембранами соседних клеток у десмосом и ВАУ близок к 180°. Встречаются части разрушенных десмосом - деформированная полудесмосома на поверхности одной клетки, соединенная с оторванной от другой клетки полудесмосомой (см. рис. 26). Обнаружены везикулы размером до 80 нм, при-соединенные к бывшей контактной поверхности клетки соединением простого типа (см. рис. 25). Под поверхностью клеток расположены большие вакуоли (впячивания) размером до 3 мкм, число которых растет к 5 мин действия повышенного давления. Структура зон слипания и плотных соединений не изменяется. Выявлены разрывы бывшей контактной поверхности гепатоцитов (см. рис. 24, 25).
Таким образом, дефицит ионов Са2+ вызывает в первую очередь снижение адгезивных свойств клеточных поверхностей в низкоадгезивной части простого соединения. Увеличение числа и размеров подповерхностных вакуолей, вероятно, указывает на повышение текучести плазмолеммы клеток. Понижена ее прочность. Длительная (20 мин) перфузия раствором Хенкса с 0,003 моль ЭДТА приводит к разрушению всех соединений гепатоцитов (Ю. П. Черненко, 1975). Однако только щелевое и плотное соединения отрываются с нарушением целостности плазмолеммы. Следовательно, дефицит ионов Ca2+ изменяет механические свойства ультраструктурных элементов контакта в следующей последовательности. Прежде всего понижается адгезивная прочность низкоадгезквной части простого соединения и прочность плазмолеммы клетки. Затем разрушаются высокоадгезивные зоны и соединения слипания. Адгезивная прочность щелевого и плотного соединений в меньшей степени зависит от концентрации ионов Ca2+ во внеклеточной среде. Таким образом, существуют три формы зависимости механических свойств соединений клеток от концентрации ионов Ca2+, которым соответствуют три группы ультраструктурных элементов контакта: низкоадгезивная часть простого соединения и плазмолемма, высокоадгезивная часть простого соединения и соединения слипания, щелевое и плотное соединения. Эти три формы могут соответствовать трем степеням связывания Ca в контакте клеток (А. Г. Меликянц, 1976).
Дальнейший этап развития одного из наиболее перспективных направлений в контактологии-изучения свойств отдельных клеточных соединений - предполагает создание представлений о функционировании МК как целостной системы. Наиболее рациональным путем решения этой задачи является последовательная разработка моделей функционирования контакта на основе физико-химических свойств отдельных соединений.
Жидкостно-динамическая модель контакта гепатоцитов. Мы установили, что десмосомы занимают наименьшую долю контактной поверхности гепатоцитов (1,8%) и обладают прочностью сцепления, сравнимой с прочностью ВАУ простого соединения. Следовательно, они вносят малый вклад в адгезивную силу, приходящуюся на всю контактную поверхность гепатоцитов. Поэтому необходимость присутствия десмосом в контакте гепатоцитов трудно объяснить только с точки зрения адгезивной связи клеток. Такое утверждение особенно очевидно для десмосом, входящих в соединительный комплекс вместе с высокопрочными зоной слипания и плотным соединением.
Если десмосомы в контакте гепатоцитов создают слабую по сравнению с другими соединениями адгезивную связь, то возникает вопрос: зачем нужны столь сложно организованные структуры в контакте этих клеток? Для ответа на этот вопрос приведем следующие сведения.
В настоящее время широкое распространение получила жидкостно-мозаичная модель клеточных мембран (S. J. Singer, G. L. Nicolson, 1972), согласно которой фосфолипидный бислой мембран представляет собой двумерную жидкость. Глобулярные молекулы интегральных белков (или гликопротеинов) погружены гидрофобгой частью в неполярную область жидкостного липидного бислоя и могут изменять свое положение (плавать) в нем. Некоторые интегральные белки пронизывают липидный бислой, имея контакт с водным окружением по обе стороны мембраны. С жидкостно-мозаичной моделью согласуются различные виды подвижности белков мембран, например, перемешивание антигенов клеточной поверхности после образования гетерокарионов и образование антигенных "шапок" у фибробластов.
Применимость жидкостно-мозаичной модели к плазмолеммам клеток, образующих контакт, ограничена, вероятно, простым соединением и соединением типа "замка". Наблюдаемые в области щелевого и плотного соединений упорядоченные структуры (D. A. Goodenough, 1976; С. Peracchia, 1977) более близки к кристаллической модели (R. A. Capaldi, D. E. Green, 1972), согласно которой интегральные белки располагаются регулярным образом.
Поскольку простое соединение составляет большую часть (78,6%) контактной поверхности гепатоцитов, то распространение жидкостно-мозаичной модели на контактные мембраны предусматривает наличие специальной системы, обеспечивающей распределение отдельных соединений на жидкостной поверхности.
На цитоплазматической стороне клеточной поверхности рас-положены белковые компоненты, образующие микрофиламентозную сеть, или пучки (микрофиламенты диаметром 4-8нм). Полагают, что эта сеть служит либо поддерживающей структурой для жидкостной мембраны, либо контрактильной системой, участвующей в различных механических явлениях - латеральной подвижности компонент, локомоции, цитокинезе и др. (H. E. Huxley, 1973; R. D. Goldman и др., 1975). Такие гипотетические заключения подтверждаются результатами ряда экспериментов. Форма клеток изменяется при действии цитохалазина В и метаболическом истощении (R. J. Weed и др., 1969; G. I. Kaye и др., 1974). Распределение и подвижность лектиновых рецепторов и частиц, адсорбированных на клеточной поверхности, изменяется при действии агентов, разрушающих микрофиламенты и микротрубочки (G. A. Albrecht-Buehler, F. Solomon, 1974; I. Yahara, G. M. Edelman, 1975). Подповерхностные филаменты немышечных клеток имеют актомиозиновую природу (R. D. Goldman и др., 1975; W. E. Gordon, A. Bushnell, 1979).
В цитоплазматической площадке десмосом обнаружены два класса филаментов: тонофиламенты диаметром 10 нм (D. E. Kelly, 1966; N. S. McNutt, 1975) и тонкие филаменты диаметром 4-6 нм (C. J. Skerrow, A. J. Matoltsy, 1974). Соответственно на цитоплазматических сколах в пределах десмосом выявлены два вида частиц: диаметром 7-8 нм и 12,5 нм, которые интерпретированы как два вида филаментов - тонкие филаменты и тонофиламенты (N. S. McNutt, R. S. Weinstein, 1973). Тонкие филаменты представляют собой контрактильные актиновые филаменты, тонофиламенты диаметром 10 нм - не контрактильные, а скелетные (P. Cooke, 1976). Возникает представление о том, что с помощью последних десмосомы входят в состав цитоскелета (D. E. Kelly, 1966; N. S. McNutt, 1975), а с помощью тонких филаментов диаметром 4-6 нм цитоплазматические площадки десмосом связаны с системой подповерхностных контрактильных микрофиламентов (В. Ф. Ушаков, 1980).
Приложение к контакту разрывающей нагрузки вызывает переход формы цитоплазматической площадки десмосом от веерообразной к стреловидной (рис. 27). Это также создает впечатление о закрепленности филаментов цитоплазматических площадок внутри клеток.
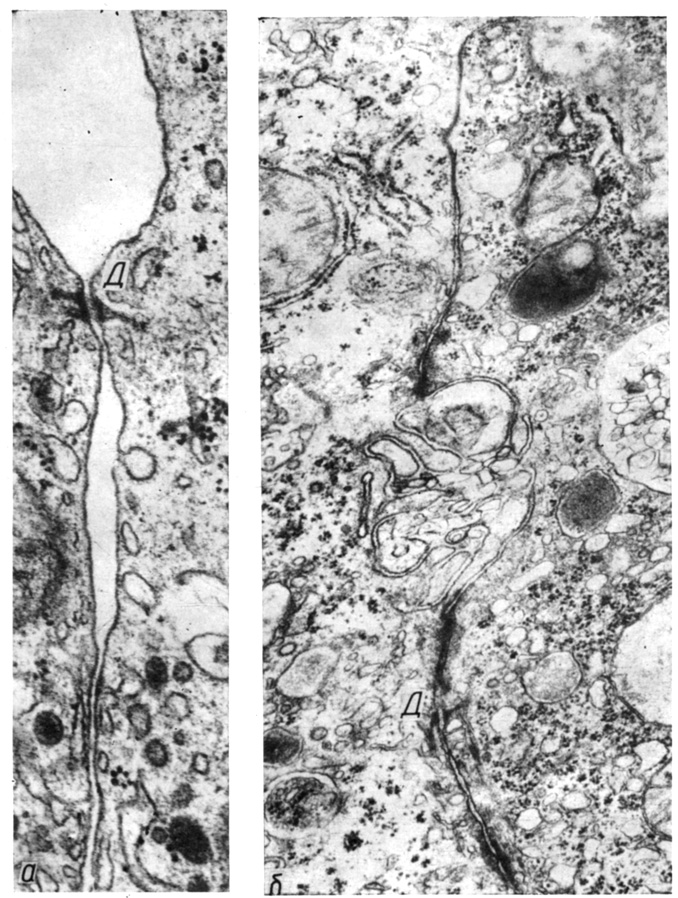
Рис. 27. Десмоса (Д) при действии разрывающего усилия на контакт гепатоцитов. Цитоплазматические площадки десмосом имеют вытянутую стреловидную форму: а - повышенное гидростатическое давление в кровеносном русле печени (66 гПа, 1 мин), б - растяжение кусочка печени. Увеличение: а - 48 000, б - 30 000
Десмосомы не встречаются во впячиваниях типа "замка". Этот факт соответствует относительной неподвижности (жесткости) десмосом в контакте гепатоцитов.
Поворот десмосом относительно общего направления контакта при действии механической нагрузки на ткань (рис. 28) свидетельствует об их способности противодействовать сдвигу соседних клеточных поверхностей относительно друг друга. Следовательно, десмосомы могут выполнять роль опорных структур в контакте для развития усилий, касательных к клеточной поверхности.
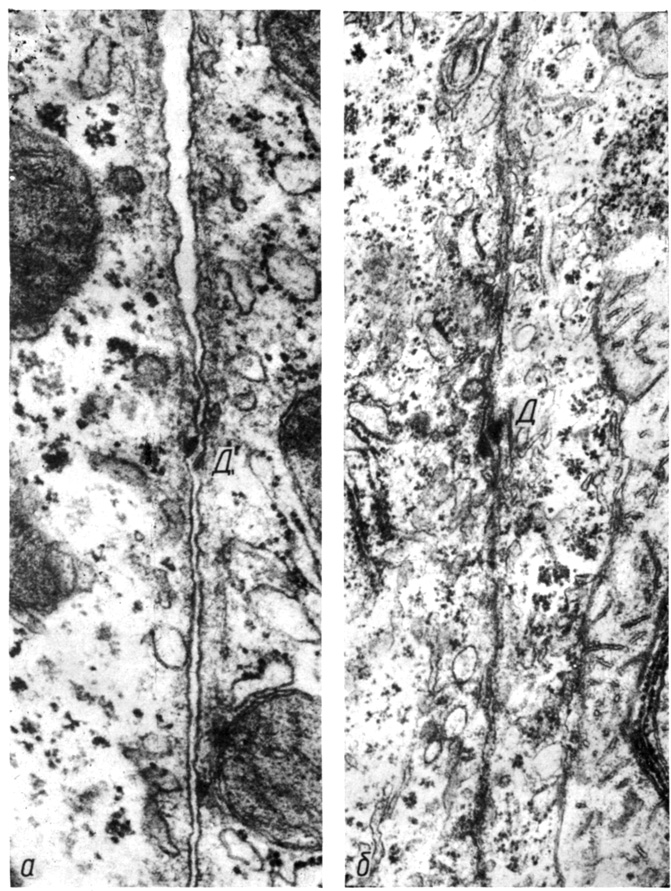
Рис 28 Поворот десмосом при действии механической нагрузки на ткань: а - десмосома (Д) при повышенном гидростатическом давлении в кровеносном русле печени (66 гПа, 1 мин), б - растяжение кусочка печени. Увеличение: а - 45 000, б - 40 000
Суммируя вышеизложенное, можно предложить следующую жидкостно- динамическую модель контакта гепатоцитов. В жидкостном липидном бислое плазмолемм, образующих простое соединение, встроены остальные соединения: плотные, щелевые, зоны слипания, десмосомы. Относительно неподвижными точками на контактной поверхности являются десмосомы, которые укреплены с помощью тонофиламентов диаметром 10 нм в цитоскелете и тонкими филаментами диаметром 4-6 нм присоединены к подповерхностной системе контрактильных (или удерживающих) филаментов. Остальные ультраструктурные элементы контакта могут изменять свое положение относительно десмосом. Наиболее подвижными являются: ВАУ, соединения типа "замка", щелевые. Распределение соединений на контактной поверхности относительно десмосом осуществляется с помощью подповерхностных контрактильных (или удерживающих) филаментов (рис.29).
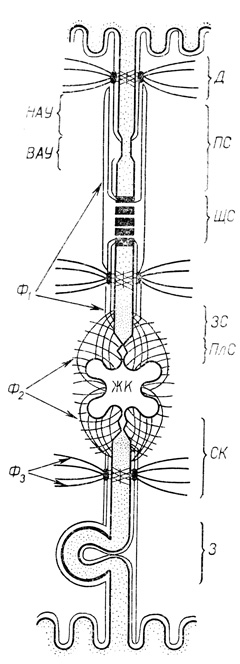
Рис. 29. Жидкостно-динами- ческая модель контакта гепатоцитов: Д - десмосома, ПС - простое соединение. НАУ - низкоадгезивная часть простого соединения, ВАУ - высокоадгезивная часть простого соединения, ЩС - щелевое соединение, ЗС - зона слипания, ПЛС - плотное соединение, СК - соединительный комплекс, З - соединение типа 'замка', Ф1 - тонкие филаменты толщиной 4-6 нм, Ф2 - актиновые филаменты, Ф3 - тонофиламенты диаметром 10 нм, ЖК - желчный каналец
Следовательно, десмосомам отводится особая роль опор (точек отсчета), закрепленных в цитоскелете, относительно которых с помощью тонких филаментов ориентированы остальные соединения. Симметрия структуры десмосом относительно соседних клеток позволяет согласовывать двигательную или удерживающую функцию подповерхностных филаментов соседних клеток. Обязательное участие десмосом в соединительных комплексах, ограничивающих полости желчных канальцев, означает в предлагаемой модели крепление зоны слипания и плотного соединения на контактной поверхности клеток. Таким образом, желчный каналец оказывается подвешенным в жидкостной мембране на опорах - десмосомах - относительно контактирующих клеток.
Не исключена возможность участия системы цитоскелет - десмосомы - подповерхностные микрофиламенты в транспорте молекулярных и надмолекулярных компонентов специализиро-ванных участков клеточной поверхности. Такое представление может оказаться полезным при изучении клеточной адгезии, механизмов действия биологически активных веществ, динамики свойств МК при физиологических процессах и патологии.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'