
Медико-биологические аспекты контактологии (Чуич Т. А., Колотенко В. П., Дзяк Г. В., Черненко Ю. П., Архипенко В. И., Рогова Н. С.)
Роль межклеточных контактов эпителиоцитов в адаптивных реакциях организма и при патологии (Чуич Т. А., Колотенко В. П.)
Роль МК в реакциях адаптации наиболее выражена в эпителиальных тканях, которые, располагаясь между внешней и внутренней средами организма, определяют устойчивость последнего к действию факторов внешней среды. Защитные свойства эпителия обусловлены состоянием свободной поверхности эпителиоцитов и МК, в составе которых барьерную функцию выполняют соединительные комплексы, включающие зону замыкания, зону слипания и десмосомы. Вместе с тем в обеспечении барьерных свойств эпителия важную роль играют простые соединения и нексусы, способствующие механическому и метаболическому объединению эпителиоцитов в единый функциональный симпласт. Согласованность в действии отдельных элементов МК эпителиоцитов, вероятно, позволяет всей системе наиболее адекватно изменять функциональное состояние в условиях адаптации. Направленность адаптационной реакции со стороны МК в значительной мере обеспечивается эффектами физиологически активных веществ, имеющих первостепенное значение в данных условиях, гормонами коркового вещества надпочечников, катехоламинами, местными тканевыми гормонами и др.
Надэпителиальная среда постоянно содержит вещества (бактерии, их токсины, ферменты, соляную кислоту, желчные кислоты и др.), прохождение которых через эпителий и попадание в кровь в значительном количестве может вызвать изменение состояния организма. Барьером на пути проникновения этих веществ через МК служат плотные соединения. До недавнего времени считали, что плотные соединения являются стабильными структурами, предотвращающими прохождение через эпителий макромолекулярных веществ. Однако в последние годы установлена их функциональная лабильность, которая, по-видимому, служит основой адаптивных процессов в эпителиальных тканях. Рассмотрим данные о лабильности МК вообще и в частности плотных соединений в различных процессах и при разных воздействиях, подчеркивая, где это возможно, адаптивный аспект обнаруживаемых изменений.
Представление о способности плотных соединений в определенных условиях пропускать через эпителий те или иные вещества подтверждается результатами экспериментов. Так, введенный в желчную систему печени крыс радиоактивный La через 2 мин определяется в крови, канальцах почки, между гепатоцитами, в просвете синусоидов и портальных венул. Это связано с тем, что метка проникает через гематобилиарный барьер по МК, включая плотные соединения.
При электронномикроскопическом исследовании проницаемости МК гепатоцитов с использованием электронноплотных меток получены разноречивые данные. Показано, что плотные соединения непроницаемы для La при его введении в кровеносную систему печени. Метка диффундирует по МК до плотных соединений, но не проникает в область желчного канальца.
Многими исследователями обнаружено изменение структуры и функции МК эпителиоцитов желудка при различных экспери-ментальных воздействиях и патологических состояниях. Установлено, что применение веществ, связывающих ионы Са2+, вызывает расширение межклеточных пространств и сопровождается увеличением проницаемости слизистой оболочки. При электронномикроскопическом исследовании МК отмечены нарушения их ультраструктуры.
Детальное исследование барьерных свойств слизистой оболочки желудка при действии различных препаратов проверено В. Frenning (1972). Он обнаружил, что салицилаты и гипертонические растворы вызывают нарушение структуры МК., проявляющееся в увеличении объема межклеточных пространств и повышении проницаемости слизистой оболочки. Увеличение поступления белков через слизистую оболочку желудка при действии салицилатов, вероятно, объясняется их способностью нарушать барьерные свойства эпителия.
Значительный материал накоплен по изучению МК эпителиоцитов слизистой оболочки кишок.
Плотные соединения МК энтероцитов в значительной мере обеспечивают стабильность энтерогематического барьера и, возможно, определяют селективный транспорт низкомолекулярных веществ через эпителий (К. А. Зуфаров и др., 1974; А. М. Меликянц, 1976). Некоторые воздействия могут изменять барьерные свойства плотных соединений. Так, использование гипертонических растворов приводит к увеличению проницаемости для фенолового красного.
При электронномикроскопическом исследовании МК эпителиоцитов обнаружено расхождение мембран в области простых и плотных соединений.
А. М. Меликянц (1976) исследовал зависимость между изменением сцепленности энтероцитов и ионной проницаемостью слизистой оболочки кишок. Им установлено, что ослабление механической связи клеток, вызванное снижением осмотического давления среды, сопровождается увеличением ионной проницаемости. Сопоставляя полученные данные с возможностями применяемых методов, автор пришел к заключению, что увеличение проницаемости слизистой оболочки кишок вызвано нарушением барьерной функции плотных соединений энтероцитов. Последние препятствуют попаданию макромолекулярных комплексов не только из кишок в кровь, но и в обратном направлении. F. D. Goebel и соавторы (1972), используя в качестве электронноплотной метки пероксидазу хрена, отметили, что после внутривенного введения метка через 10-30 мин обнаруживалась в межклеточном пространстве, достигала апикальной части клеток, но не проникала в просвет кишок. О функциональной лабильности МК энтероцитов свидетельствуют данные по исследованию механической связи клеток при действии различных биологически активных соединений. Нами установлено, что инкубация стенки кишок в растворах, содержащих стероиды (глюкокортикоиды, половые гормоны) и другие биологически активные соединения, сопровождается изменением сцепленности энтероцитов.
Проницаемость слизистой оболочки кишок зависит от возраста организма. У новорожденных всасывание в кишках протекает более интенсивно, чем у взрослых. У большинства новорожденных кишки способны пропускать нерасщепленные белковые молекулы (Р. О. Файтельберг, 1976). Если принять во внимание, что формирование МК в онтогенезе осуществляется?
в течение первых недель жизни и для установления дефинитивной структуры МК необходим определенный уровень гормонов, то можно предположить, что транспорт макромолекул осуществляется по МК, которые способны опознавать и регулировать поступление через слизистую оболочку необходимых для организма высокомолекулярных веществ (например, иммуноглобулинов матери). Повышенной проницаемостью кишок ново-рожденных объясняются частые аллергические реакции у детей.
Кишки экспериментальных животных, наряду с другими гладкомышечными органами, являются классической моделью, используемой патофизиологами для изучения аллергических ре-акций. Анафилактическая реакция гладкой мускулатуры органа определяется взаимодействием антигена с антителом, и ее развитие в значительной степени зависит от способа введения разрешающей дозы антигена. Проведено сравнительное изучение действия антигена на сенсибилизированную кишку в зависимости от места его приложения. Действие антигена со стороны серозной оболочки сопровождалось развитием сильной контрактуры; при действии антигена со стороны слизистой оболочки реакция развивалась значительно медленнее и с латентным периодом, а при воздействии со стороны слизистой оболочки эффект был менее быстрый и выраженный (A. J. Kendall, P. J. Varney, 1927). Авторы считают, что щелочная среда повышает проницаемость слизистой оболочки для антигена. А. Г. Меликянц (1976) установил, что увеличение рН инкубационной среды приводит к ослаблению сцепленности эпителиоцитов кишок и увеличению трансэпителиального транспорта через слизистую оболочку. Хорошо изучена роль МК в регуляции проницаемости серозных оболочек. Известно, что транспорт веществ через мезотелий осуществляется по двум путям: транс- и парацеллюлярно. Регуляция пассивного транспорта в значительной мере обеспечивается состоянием плотных соединений мезотелиоцитов. Такие крупные молекулы, как пероксидаза хрена, проникают через МК мезотелиоцитов.
Г. В. Буланова (1976) изучала транспорт пероксидазы хрена из полости перикарда и установила, что, наряду с везикулярным поступлением, метка проникает через серозный барьер по МК. Автор считает, что межклеточный путь является одним из основных для переноса водорастворимых белков через мезотелий. Аналогичные результаты получены при исследовании транспорта пероксидазы через эпикард и эндокард куриного эмбриона.
Применение сканирующего электронного микроскопа позволило обнаружить плотные контакты между клетками мезотелия, выявляемые в виде кратерообразных углублений. Предполагают, что они соответствуют так называемым стомам, обеспечивающим транспорт крупномолекулярных соединений. Проницаемость мезотелия изменяется при действии гистамина, температуры, динитрофенола.
Мы исследовали проницаемость брюшины крыс для витального красителя и белков при действии глюкокортикоидов в различных экспериментальных условиях. Выявлена зависимость проницаемости брюшины от концентрации глюкокортикоидов в инкубационной среде и организме. Инсулин, морфин, экзогенные РНК также изменяют проницаемость брюшины для витальных красителей.
Функциональные особенности выделительной системы зависят от состояния МК эпителиоцитов. Между мезангиальными и дольчатыми клетками клубочков обнаружены нексусы, способствующие образованию функционального синцития. Повышение внутриканальцевого давления сопровождается нарушением барьерной функции эпителия - крупномолекулярные электронноплотные метки (ферритин, торотраст) обнаруживаются в области МК.
МК слизистой оболочки мочевого пузыря претерпевают структурно-функциональные изменения в различных условиях. Воздействие на слизистую оболочку гипертонических растворов некоторых веществ (сахароза, мочевина) приводит к снижению разности потенциалов и электрического сопротивления стенки мочевого пузыря. При этом МК становятся проницаемыми для молекул пероксидазы хрена. Повышение внутриорганного гидростатического давления сопровождается расширением МК эпителиоцитов, но их барьерная функция при этом не нарушается. Вероятно, функциональная активность плотных соединений в этих условиях не изменяется. Действие гипертонических растворов маннитола приводит к резкому расширению МК эпителиоцитов в области простых соединений. Плотные соединения в этих условиях оставались интактными. Обнаружено нарушение структуры плотных соединений в контактах эпителиоцитов мочевого пузыря при экспериментальной гипертонии.
Эпителий кожи постоянно подвергается действию различных повреждающих факторов. Нормальное состояние МК эпидермиса является необходимым условием сохранения барьерных свойств кожи. Изменение свойств МК сопровождается усилением проницаемости кожи для различных факторов внешней среды. Инкубация кожи в растворе мочевины повышает ее проницаемость для La и сахарозы, что обусловлено снижением барьерной функции МК.
Нарушение межклеточных связей в эпителии рта гвинейских свинок отмечено при их содержании на диете без аскорбиновой кислоты. Наиболее выраженные изменения выявлены со стороны десмосом. МК ацинозных клеток поджелудочной железы препятствуют проникновению пищеварительных ферментов из просвета панкреатического ацинуса в подэпителиальные ткани.
Наиболее значимыми с точки зрения практической медицины представляются данные об изменении свойств МК эпителиоцитов в условиях стрессовой реакции. Состояние наивысшего напряжения всех жизненно важных систем организма мобилизирует резервные защитные свойства эпителиальных пластов при действии повреждающих факторов, микробов и продуктов их жизнедеятельности, постоянно присутствующих в надэпителиальном пространстве. В этих условиях от барьерных свойств эпителия зависит направленность дальнейшего развития адаптивных реакций: приспособление или развитие патологии.
Еще Г. Селье (1960) показал, что одним из критериев развития реакции напряжения наряду с гипертрофией коркового вещества надпочечников и инволюцией тимико-лимфатического аппарата является образование кровоизлияний в пищевом канале. Указанная триада симптомов выявлялась в организме экспериментальных животных при действии различных стрессоров. Г. Селье на основании многочисленных экспериментальных данных приходит к выводу, что приспособительные реакции обеспечиваются способностью ряда гормонов (ДОКС, КС, СТГ) повышать резистентность организма к стрессору. В течение ряда лет мы изучали свойства МК эпителиальных тканей при стрессе и в условиях применения адаптивных гормонов. Патогенез повреждения слизистой оболочки желудка и образования язв при стрессе исследован Н. А. Чуич (1975). Установлено, что иммобилизация животных по методу Селье приводит к выраженному повреждению слизистой оболочки. Это проявляется в дезинтеграции эпителиоцитов (ослаблении межклеточной адгезии) и повышении сорбции витального красителя. Аналогичная реакция со стороны слизистой оболочки отмечена при введении животным больших доз преднизолона. Высказано предположение, что, наряду с известными патогенетическими механизмами, важную роль в образовании язв играет нарушение барьерных свойств МК эпителиоцитов.
Исследование ультраструктурных изменений МК эпителиоцитов желудка при стрессе проведено Е. В. Косько и соавторами (1976). Они наблюдали расширение межмембранного пространства в области простых соединений, которые в значительной мере обеспечивают механическую интеграцию эпителиоцитов. Длительное введение синтетического аналога глюкокортикоидов - преднизолона - сопровождается ослаблением сцепленности клеток печени (Г. А. Чуич, 1970).
При изучении свойств МК гепатоцитов в динамике стрессовой реакции (иммобилизация животных по Г. Селье) наиболее выраженное ослабление сцепленности клеток отмечено через 6 ч. Обнаружена зависимость состояния межклеточных связей гепатоцитов от количества кортикостероидов в крови животных. Сопоставление данных о сцепленности гепатоцитов в условиях стресса и при введении преднизолона позволило выявить различия в изменении свойств МК. Вероятно, они обусловлены тем, что при стрессе свойства МК регулируются всеми адаптивными механизмами организма. Изменение свойств МК после введения преднизолона в значительной мере обусловлено эффектами глюкокортикоидов. В условиях стресса нарушается ультра-структура МК гепатоцитов.
К. А. Зуфаров и соавторы (1974) установили, что на ранних этапах компенсаторно-приспособительных реакций в некоторых органах пищевого канала наблюдаются выраженные структурно-функциональные изменения в слизистой оболочке. Наряду с повышением активности внутриклеточных репарационных систем компенсаторно-приспособительная реакция выявлена и на тканевом уровне - повышение пролиферативной активности энтероцитов, ослабление межклеточных связей. Последнее, вероятно, является причиной прохождения по межклеточным пространствам не только крупномолекулярных веществ (липиды, белки), но даже целых клеток.
Нарушение структуры МК эпителиоцитов кишок обнаружено у больных с клинически выраженными симптомами малабсорбции. Отмечено нарушение структуры плотных соединений и увеличение объема межклеточных пространств. Различные патологические состояния сопровождаются повышением проницаемости кишок для белков, проникновение которых в кровь, по-видимому, служит причиной сенсибилизации организма (Р. О. Файтельберг, 1976). Очевидно, ширина межклеточных пространств в эпителии кишок может отражать функциональное состояние слизистой оболочки.
Проблема патогенеза инфекционных болезней в настоящее время еще недостаточно изучена. Представляют интерес работы, посвященные ультраструктурным основам адаптивных реакций эпителиальных тканей при взаимодействии микробов и их токсинов с эпителиями. С. Л. Гохберг, Н. И. Расулев (1976) исследовали ультраструктуру слизистой оболочки толстой кишки больных неспецифическим язвенным колитом и крыс с экспериментальным аллергическим хроническим язвенным колитом. Отмечено проникновение микроорганизмов через апикальную часть бокаловидных клеток в цитоплазму и миграция их к базальной мембране, а также нарушение структуры гликокаликса, в известной мере определяющего барьерные свойства эпителия. Состояние МК эпителиоцитов больных в стадии ремиссии существенно не отличается от нормы, хотя наблюдаются многочисленные интердигитации боковых плазмолемм без изменения их взаимно параллельного расположения. В эпителиоцитах больных неспецифическим колитом в стадии обострения обнаружено выраженное нарушение структуры контактов, проявляющееся в резком расширении межклеточных пространств, расправлении интердигитаций с образованием широких лакун, имеющих непосредственное сообщение с базальной мембраной. Авторы считают, что лабильность боковых плазмолемм эпителиоцитов, сопровождающаяся увеличением резервного объема межклеточных пространств,- проявление мобилизации защитно-компенсаторной реакции слизистой оболочки на клеточном уровне.
Аналогичные данные получены А. В. Цинзерлингом и соавторами (1976), исследовавшими ультраструктурные изменения эпителиоцитов толстой кишки кроликов при дизентерии и экспериментальном шигеллезе. Наряду с изменениями щеточной каймы энтероцитов, авторы обнаружили нарушение структуры и функции МК - расширение межклеточных пространств и высвобождение эпителиоцитов из связи с соседними. В области межмембранного пространства выявлялись бактерии, лейкоциты и лимфоциты.
Б. В. Втюрин, Р. И. Каем (1976) установили, что при стрессе (экспериментальная ожоговая травма крыс) изменяются МК энтероцитов тонкой кишки. Нарушается структура соединительных комплексов, в области межклеточного пространства образуются крупные лакуны, вследствие чего происходит дискомплексация эпителия и микробы проникают через энтероцитарный барьер в слизистую оболочку.
Ю. П. Петров, Ю. В. Постнов (1974) при изучении ультра-структуры почки крыс при экспериментальной солевой гипертонии обнаружили нарушение структуры МК эпителиоцитов нефрона и собирательных трубок и наблюдали образование полостей между клетками. Авторы пришли к выводу, что увеличение объема межклеточных промежутков свидетельствует об интенсификации транспортных процессов через эпителий.
Приведенные данные позволяют считать, что МК играют важную роль в функциональной организации тканевых систем как целого. Наличие специализированных структур в составе МК в значительной мере обеспечивает выполнение тканями специфических функций. Последнее требует согласованности в действии всех специализированных элементов контакта. Можно предполагать, что управление функциональной активностью тканей и системы в целом определяется способностью физиологически активных соединений (регуляторов тканевого уровня, гормонов, медиаторов) изменять свойства МК. Так, показано, что специфическая реакция ткани на гормональный стимул может быть сохранена только в условиях целостности тканевой организации. Синхронизация сокращения отдельных гладкомышечных клеток матки кастрированных крыс достигается лишь с формированием щелевых соединений между ними. Появление желчных кислот в культуре эмбриональной печени требует организации отдельных клеток в дифференцированную тканевую структуру с образованием МК.
Существенным является понимание роли МК в развитии патологического процесса. Можно предположить, что спектр функциональной активности ткани, обусловленный состоянием МК, определяет реакцию всей тканевой системы. Однако при действии на организм чрезмерных раздражителей (стрессоров) или повреждающих факторов, приводящих к длительной дестабилизации той или иной функции МК, возможно нарушение механизма адаптации и развитие патологического процесса на уровне ткани, органа или организма.
Нарушение свойств МК сопровождается дезинтеграцией ткани с изменением ее функциональной организации и, вероятно, в большинстве случаев является причиной развития патологии (Г. А. Крыжановский, 1974). Проводя аналогию с высказыванием А. Поликара о гибели органелл клетки независимо друг от друга, можно отметить, что клетки (в системе ткани) "живут вместе, но умирают и выживают по одиночке", разобщаясь при нарушении МК. Об этом свидетельствуют данные об обособлении отдельных клеток тканевой системы при различных физиологических (митоз, кератинизация, элиминация эпителиоцитов при физиологической регенерации) и патологических процессах (опухолевый рост).
Таким образом, исследование роли МК в развитии адаптивных реакций и патологических процессов необходимо для получения полной информации о нарушении функциональной активности тканевой системы (органа), так как состояние МК в значительной степени характеризует направление ее поведенческой реакции (функции) и может служить тестом для выбора способа управления.
Исследование функциональных особенностей на тканевом и органном уровне организации посредством изучения свойств МК и межклеточных взаимодействий приблизит нас к пониманию путей терапии различных патологических процессов.
Действие глюкокортикоидов на межклеточные контакты гепатоцитов (Колотенко В. П.)
Существует несколько перспективных направлений внедрения в практическое здравоохранение результатов, достигнутых в экспериментальной контактологии. Основные из них: 1) разработка диагностических методик, позволяющих объективно оценить различные аспекты функционирования МК в органной структуре; 2) направленное изменение проницаемости тканевых барьеров путем влияния на соответствующие структуры МК как терапевтический прием, изменяющий межклеточные взаимодействия на этапах патогенетической терапии заболеваний; 3) поиск и создание контактотропных соединений, способных регулировать функциональную активность МК непосредственно или за счет активации эндогенных регуляторных систем; 4) динамический контроль за течением патологического процесса и терапевтического воздействия на него.
Одной из актуальнейших проблем практической медицины является отбор рационального, научно обоснованного метода применения лекарственных средств и особенно гормональных препаратов. Из гормонов, используемых в клинике, наиболее широкое распространение получили кортикостероиды. Это объясняется, вероятно, тем, что они применяются не только в качестве средств заместительной терапии, но и при ряде заболеваний, возникновение и развитие которых трудно объяснить с позиций нарушения функций эндокринной системы организма.
Наиболее выражен эффект использования кортикостероидов при коллагенозах, аллергических реакциях, инфекционных заболеваниях, в онкологии, дерматологии, оториноларингологии, кардиологии, хирургии, при заболеваниях органов кроветворения, пищевого канала, выделительной системы и др. Кортикостероиды являются незаменимым средством при терапии неотложных состояний организма (П. Д. Горизонтов, Т. Н. Протасова, 1968). По мнению Л. И. Егоровой (1972), кортикостероиды по силе действия и ширине применения можно сравнить с антибиотиками, а успех от их использования при аддисоновой болезни и опухолях надпочечников - с эффектом инсулиновой терапии при сахарном диабете.
Однако нередко обнаруживаются побочные эффекты гормонов, которые могут привести к возникновению различных осложнений и даже гибели организма. Объяснение причин развития негативных эффектов кортикостероидов до сих пор остается на уровне предположений, гипотез. Вероятно, поэтому в последние годы интерес исследователей, изучающих эффекты кортикостероидов, направлен на выяснение молекулярных механизмов их действия. Хорошо изучены механизмы биосинтеза и метаболической трансформации кортикостероидов (Н. А. Юдаев и др., 1976), их транспорта и распределения в организме (Б. В. Розен, 1970), взаимодействия с рецепторами клеток-мишеней и их органоидами (П. В. Сергеев и др., 1971). Имеющийся фактический материал позволяет достаточно полно представлять молекулярные механизмы регуляции кортикостероидами активности генетического аппарата клеток (E. B. Thompson, М. Е. Lipmann, 1974).
Несмотря на столь значительные достижения молекулярной эндокринологии в изучении механизма действия гормонов, практическая медицина еще не получила четких критериев рационального использования гормонов в клинике. Анализ фактического материала позволил обнаружить следующее противоречие: кортикостероиды, являясь незаменимым средством нормализации многих патологических состояний организма, требуют широкого использования в клинике; с другой стороны, нерациональное применение гормонов служит причиной развития осложнений и даже гибели организма. Это противоречие может быть устранено при решении двух задач: 1) поиск новых препаратов, обладающих кортикостероидной активностью, не провоцирующих негативных реакций организма; 2) выбор критериев рационального использования известных кортикостероидов.
Решение первой задачи возможно на уровне разработки нового методического подхода, в частности создания экспериментальной модели, обладающей высокой производительностью, экономичностью и надежностью прогноза. Вероятно, в качестве такой модели можно выбрать метод или группу методов и объектов исследования, позволяющих оценивать кортикостероидную активность испытываемого вещества по реакциям объектов исследования при действии известных кортикостероидов in vitro. Критериями отбора химических соединений по кортикостероидной активности могут быть показатели, полученные с помощью используемых методов и составляющие алгоритм поведенческих характеристик объекта при действии веществ с известной кортикостероидной активностью. Создание "кортикостероидного алгоритма" - своеобразного ключа к определению кортикостероидной активности химического соединения - воз-можно при соблюдении следующих требований, предъявляемых к экспериментальной модели: 1) объекты исследования должны в максимальной степени обладать чувствительностью к кортикостероидам, т. е. служить объектами-мишенями для гормонов; 2) методы оценки активности кортикостероидов должны выбираться адекватно биологической роли гормонов в организме, т. е. быть достаточно чувствительными для выявления особенностей реакции объектов при действии кортикостероидов.
Для подтверждения возможности создания системы поиска, отбора и испытания веществ с определенным видом биологической активности авторами предложена экспериментальная модель, позволяющая проводить отбор веществ, обладающих свойствами глюкокортикоидов, т. е. построить "глюкокортикоидный алгоритм". В основу экспериментальной модели положена группа биофизических методов, показатели которых характеризуют свойства объектов исследования на надмолекулярном, клеточном и тканевом уровнях организации. Стремление авторов к возможности сопоставления реакций тест-объектов, выявляемых на клеточном и тканевом уровнях под влиянием глюкокортикоида, обусловило разработку целевых биофизических методов, в которых используется идентичное проявляющее воздействие- механическое (Г. А. Чуич, 1968; В. И. Архипенко и др., 1975; В. П. Колотенко, 1977). Учитывая приспособительную роль глюкокортикоидов в организме, применяли такие методы исследования, чтобы определяемые показатели характеризовали адаптивные (защитные) реакции исследуемых объектов на соответствующих уровнях.
Критериями оценки биологической активности исследуемых веществ служили биофизические показатели состояния клеточной поверхности (резистентность и репарационная способность) и МК (сцепленность клеток, способность их к реассоциации, трансэпителиальный транспорт веществ) эпителиоцитов, а также ультрамикроскопическая картина изменений объектов исследования. Чтобы выяснить зависимость влияния глюкокортикоидов от концентрации и времени их действия, исследование реакций объектов проводили в концентрационно-временном аспекте. В качестве тест-воздействия для проявления специфических реакций тест-объектов использовали синтетический препарат с выраженными глюкокортикоидными свойствами, аналог естественных глюкокортикоидов - преднизолон. Тест-объектами служили клетки и тканевые фрагменты печени. Применены методы количественной оценки резистентности изолированных гепатоцитов, количественной оценки репарационной способности изолированных гепатоцитов, количественной оценки сцепленности гепатоцитов друг с другом, количественной оценки способности гепатоцитов к реассоциации, количественной оценки трансэпителиального транспорта веществ, электронной микроскопии.
Выявление эффектов преднизолона на клеточном уровне требует получения изолированных жизнеспособных гепатоцитов, что связано с методическими трудностями. Необходимым условием изоляции клеток является разрушение структур МК. С этой целью используют различные химические (хелаты, ферменты), физические (рН, температура, осмос, механическое воздействие) и комплексные (химические совместно с физическими) воздействия. Общепризнан метод перфузии печени растворами, содержащими контактотропные вещества, с последующим механическим диспергированием ткани (P. O. Seglen, 1972), который был применен в нашей модификации. В опытах использовали суспензию, в которой количество поврежденных клеток составляло не более 30%. Оценку жизнеспособности клеток проводили методами морфологического (витальное окрашивание трипановым синим и электронномикроскопическое исследование) и функционального (гликогенообразовательная функция) контроля. О механических свойствах клеточной поверхности изолированных гепатоцитов судили по устойчивости их к действию механического повреждения. Для определения механической устойчивости гепатоцитов использовали специальное устройство - дезинтегратор клеток (рис. 34).
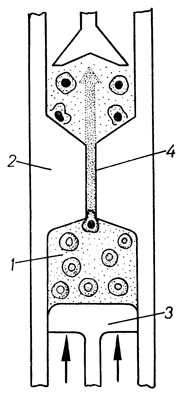
Рис. 34. Схема дезинтегратора и принцип метода оценки резистентности изолированных клеток: 1 - суспензия клеток, 2 - корпус дезинтегратора, 3 - поршень, 4 - калиброванное отверстие
Исследуемую суспензию клеток (1) в нужном количестве помещали в камеру дезинтегратора (2) и с помощью поршня (3) пропускали через калиброванное отверстие (4). При этом часть клеток разрушалась. Условия повреждения (скорость и время прохождения суспензии через отверстие) контролировали с помощью электромеханического привода. Для количественного определения показателя устойчивости клеток использовали формулу:
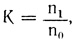
где К - коэффициент устойчивости клеток; n1 - количество клеток после нанесения повреждения; n0 - исходное количество клеток в суспензии.
Клетки подсчитывали в камере Горяева или с помощью целлоскопа.
Для оценки репарационной способности клеточной поверхности применен метод В. И. Архипенко (В. И. Архипенко и др., 1975). Суспензию жизнеспособных гепатоцитов делят на две равные части и определяют количество клеток в каждой из них (N1 и N2). Клетки первой (N2) и второй (N1) частей подвергают повреждению в специальном устройстве (см. рис. 34), пропуская суспензию через калиброванное цилиндрическое отверстие с разными условиями повреждения: клетки первой части непрерывно, второй - с интервалами между повреждениями. Интенсивность и длительность повреждающего воздействия в обоих случаях были одинаковыми. После повреждения часть клеток разрушается.
Количество оставшихся клеток в первой (n1) и во второй (n2) частях суспензии определяли с помощью камеры Горяева или целлоскопа. Количественно репарационную способность гепатоцитов определяли по формуле:
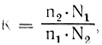
где К-показатель репарации.
Схема метода представлена на рис. 35.
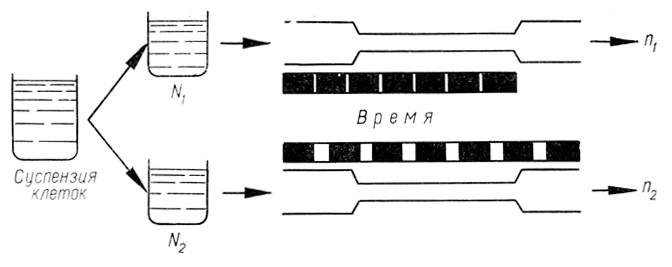
Рис. 35. Схема метода оценки репарации клеток
Для оценки величины сцепленности гепатоцитов применен метод жидкостной дезинтеграции (В. И. Архипенко и др., 1974) в нашей модификации (рис. 36).
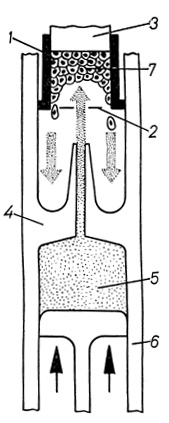
Рис. 36. Схема метода жидкостной дезинтеграции ткани: 1 - капсула дезинтегратора, 2 - капроновая сетка, 3 - фиксатор, 4 - корпус дезинтегратора, 5 - изотонический раствор, 6 - шприц, 7 - ткань
Отрыв клеток от образца проводили в специальном приборе - жидкостном дезинтеграторе. С этой целью гкань помещали в капсулу прибора (1), ограниченную с одной стороны капроновой сеткой (2), размеры ячеек которой пропускают гепатоциты. Образец фиксировали ограничителем (3), а затем капсулу с тканью помещали в корпус дезинтегратора (4) и закрепляли. Струя изотонической жидкости (5), направленная из шприца (6') перпендикулярно поверхности среза ткани, проходя сквозь ячейки сетки, пробивает образец, отрывая при этом клетки. Клетки отрывали однократным пробиванием образца тканей раствором Хенкса со скоростью 6 мл в 1 с. Объем раствора составлял 6 мл, температура - 36-37° С. Гепатоциты подсчитывали в камере Горяева или с помощью целлоскопа. Сцепление клеток оценивали по величине, обратной количеству сорванных при дезинтеграции клеток, с учетом их разрушения. При этом использовали следующую формулу:
| N = | n | |
| α |
где N - количество сорванных клеток с учетом разрушения; n - количество клеток, определяемое после дезинтеграции; α - коэффициент механической резистентности клеток.
Для определения коэффициента механической устойчивости клеток применяли суспензию, полученную в результате дезинтеграции ткани. Коэффициент резистентности определяли вышеописанным способом. Постоянство условий дезинтеграции достигалось использованием специального электромеханического привода.
С целью определения способности гепатоцитов восстанавливать адгезивные свойства разработан метод количественной оценки реассоциации клеток в тканевой системе (рис. 37). Метод основан на ослаблении межклеточных связей декальцинацией ткани с по-следующим восстановлением адгезивных свойств клеток.
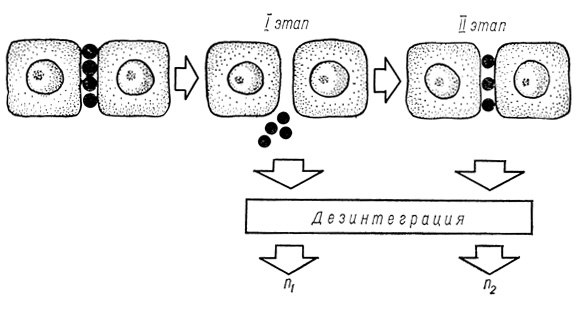
Рис. 37. Схема метода оценки реассоциации клеток в ткани
Ослабление и восстановление межклеточных связей осуществляли перфузией органа в два этапа. Разобщение ткани на первом этапе достигалось перфузией печени через портальную вену раствором Хенкса, в котором ионы Ca2+ были эквимолярно заменены ионами Mg2+. Для определения сцепленности клеток после первого этапа отрезали часть центральной доли органа после перевязки центральной внутридолевой вены в области разреза. На втором этапе печень перфузировали при тех же условиях раствором, содержащим исследуемое вещество. Сцепленность клеток исследовали после каждого этапа методом жидкостной дезинтеграции. Коэффициент реассоциации клеток определяли по формуле:
| K = | n1 | |
| n2 |
где К - коэффициент реассоциации клеток; n1 - количество клеток, отрываемое от образца ткани после декальцинации; n2 - количество клеток, отрываемое от образца ткани после действия исследуемого вещества.
Для оценки трансэпителиального транспорта использовали методы в зависимости от объектов исследования.
Определение трансмезотелиального транспорта веществ на брюшине проводили с помощью метода, сущность которого заключается в следующем (см. схему метода на рис. 38).
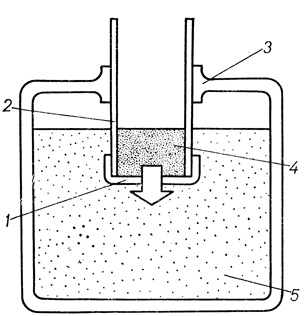
Рис. 38. Схема метода оценки трансмезотелиального транспорта веществ: 1 - брыжейка кишечника, 2 - стеклянный цилиндр, 3 - инкубационная камера, 4 - индикатор проницаемости, 5 - изотонический раствор
После выделения из брюшной полости тонкую кишку животного отмывали от содержимого, заполняли физиологическим раствором и перевязывали с обоих концов. Свободную от жировой клетчатки и кровеносных сосудов часть брыжейки (1) в расправленном состоянии помещали на торец полого стеклянного цилиндра (2) и фиксировали лигатурой. Оставшуюся часть брыжейки отсекали. Стеклянный цилиндр с закрепленной на нем брыжейкой помещали в специальную камеру (3), заполненную раствором Хенкса. Одновременно цилиндр заполняли раствором, содержащим индикатор проницаемости, до тех пор, пока его уровень не соответствовал уровню раствора в камере. Концентрацию индикатора проницаемости, проникшего через тканевой барьер в камеру, определяли с помощью электроколориметра ФЭК-М.
Трансэпителиальный транспорт веществ в печени исследовали, используя перфузионную модель органа.
Печень перфузировали через портальную вену раствором Хенкса. В общий желчный проток нагнетали раствор желчи. Перед использованием препарат желчи разбавляли раствором Хенкса в соотношении 1 : 10. Индикатор проницаемости (желчь), проникая через гепато-билиарный барьер, поступал в кровеносную систему органа (рис. 39). В динамике перфузии через определенные интервалы времени в перфузате определяли концентрацию индикатора проницаемости и по результатам измерений строили кривую зависимости изменения концентрации индикатора в кровеносной системе от времени перфузии органа. Барьерные свойства контактов оценивали по времени, необходимому для установления постоянной концентрации индикатора в кровеносной системе и максимальному значению концентрации индикатора.
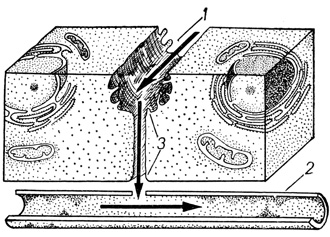
Рис. 39. Схема гемато-билиарного барьера: 1 - желчный каналец, 2 - кровеносный капилляр, 3 - МК (стрелками указано направление движения индикатора проницаемости)
Для электронномикроскопического исследования из левой латеральной доли печени вырезали кусочки размером не более 1 мм3. Фиксацию и контрастирование ткани проводили по общепринятому методу. Ультратонкие срезы готовили на ультрамикротоме УМТП-2, переносили их на медные сетки диаметром 2 мм, покрытые подложкой из формвара, дополнительно контрастировали раствором лимоннокислого свинца и исследовали в электронном микроскопе УЭВМ-100К.
При оценке данного вида активности различных соединений условия применения методов исследования должны быть одинаковыми.
Вышеуказанные биофизические показатели состояния клеточной поверхности (резистентность и репарация) и МК (сцепленность, реассоциация, трансэпителиальный транспорт) эпителиоцитов, а также данные электронной микроскопии (морфологическая интерпретация состояния исследуемых объектов) характеризуют барьерные свойства эпителия как единой функциональной системы. Это позволяет наиболее полно познать биологический смысл определяемых изменений под влиянием испытываемого физиологически активного соединения, в частности глюкокортикоида.
Наиболее характерной особенностью действия глюкокортикоидов на поверхностные мембранные структуры клеток является способность гормонов изменять их стабильность к действию различных повреждающих факторов. Мембранотропные эффекты глюкокортикоидов зависят от концентрации гормона в организме животных или инкубационной среде, а также от времени действия гормона. К такому заключению можно прийти, анализируя данные ряда авторов, полученные на разнообразных объектах (P. M. Seeman, 1966; П. В. Сергеев и др., 1971). В большинстве случаев изучали временную или концентрационную зависимость эффектов гормонов, что не позволяет составить полной характеристики их действия.
Нами изучена резистентность изолированных клеток печени к механическому повреждению в зависимости от изменения концентрации преднизолона и времени его действия. Опыты проведены на 6 белых беспородных крысах-самцах массой 150-160 г.
Из печени каждого животного получали суспензию гепатоцитов, делили ее на две части: контрольную и подопытную. Клетки каждой из частей инкубировали в среде 199 при температуре раствора 37° С в течение 4 ч. Инкубацию проводили в условиях аэрации и перемешивания среды. Преднизолон использовали в концентрациях 4⋅10-9; 4⋅10-8; 4⋅10-7; 4⋅10-6; 4⋅10-5 и 4⋅10-4 моль. В процессе инкубации через каждый час из контрольной и подопытной частей брали по 6 мл суспензии для оценки резистентности клеток к механическому повреждению.
На основании полученных данных построено графическое изображение эффектов преднизолона, представляющее собой "поверхность", располагающуюся в трехмерной системе координат. Это позволяет выявить специфические особенности в концентрационно-временных эффектах исследуемых веществ, которые могут служить критериями отбора аналогичных по механизму действия тестируемых соединений. Кроме того, при отборе соединений необходимо учитывать характер морфологии "поверхности". Такая "поверхность" для концентрационно-временных эффектов преднизолона при оценке его влияния на резистентность изолированных гепатоцитов крыс in vitro представлена на рис. 40. Отбор соединений, обладающих активностью глюкокортикоидов в данных условиях (проведение испытаний in vitro, выбор концентрации соединения, времени экспозиции соединения с клетками) может осуществляться по следующим критериям:
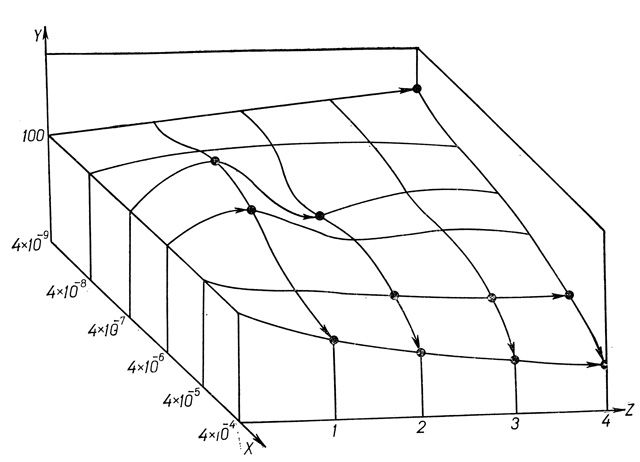
Рис. 40. Зависимость механической устойчивости изолированных гепатоцитов от концентрации преднизолона и продолжительности обработки. По осям: х - концентрация преднизолона (в молях) в инкубационной среде, у - величина показателя резистентности (в %). z - продолжительность обработки (в часах)
1. Эффективная концентрация вещества - концентрация, при которой вещество вызывает достоверное изменение исследуемого показателя в определенных временных интервалах. Например, эффективной можно считать концентрацию преднизолона, равную 4⋅10-7 моль при экспозиции гепатоцитов с преднизолоном в течение 1 и 2 ч.
2. Эффективное время действия вещества - время, при котором отмечается достоверное изменение показателя резистентности при использовании различных концентраций преднизолона и в выбранном диапазоне. Например, при использовании преднизолона в концентрации 4⋅10-7 моль эффективное время действия составляет 1 ч и 2 ч.
3. Характер изменения показателя резистентности во времени при действии минимальной (4⋅10-9 моль), максимальной (4⋅10-4 моль), физиологической (4⋅10-7 моль) и стрессовой (4⋅10-6 моль) концентраций преднизолона. Например, при использовании дозы глюкокортикоида 4⋅10-9 моль достоверное увеличение показателя резистентности отмечено только к 4-му часу экспозиции. Концентрация преднизолона 4⋅10-4 моль приводит к достоверному снижению исследуемого показателя уже к 1-му часу инкубации, и эта зависимость определяется в дальнейшем на всем протяжении действия преднизолона. Действие физиологической концентрации преднизолона (4⋅10-7 моль) сопровождается двухфазным изменением резистентности гепатоцитов: повышение через 1 ч и снижение через 2 ч действия гормона.
4. Характер изменения показателя резистентности по градиенту концентрации преднизолона (от 4⋅10-9 моль до 4⋅10-4 моль) через 1, 2, 3 и 4 ч инкубации.
5. Особенности морфологии "поверхности". На основании проведения такого анализа действия глюкокортикоида в указанных условиях можно создать "образ эффектов" преднизолона, составляющими которого будут служить "эффективные точки" и "эффективные направления" действия гормона (рис. 40). Сопоставление "образов эффектов" глюкокортикоида и тестируемого соединения позволит установить, обладает ли испытываемое вещество в данных условиях его применения свойствами, характерными для глюкокортикоидов.
Для более полной характеристики эффектов глюкокортикоида на клеточном уровне можно использовать и другие показатели состояния клеток, определяемые при известных условиях исследования в концентрационно-временном аспекте. Целесообразно выбирать специфические для эффектов глюкокортикоидов адаптивные тест-реакции. Это не значит, что в качестве критериев отбора не могут выступать показатели неспецифических реакций клеток.
Авторы исследовали способность преднизолона изменять репарационные свойства изолированных гепатоцитов крыс in vitro в динамике действия глюкокортикоида. Дозу и время действия преднизолона выбирали исходя из результатов экспериментов по влиянию гормона на резистентность клеток в этих же условиях. Преднизолон был наиболее эффективен в концентрации 4⋅10-7 моль через 1 и 2 ч от начала инкубации. Снижение репарационного потенциала гепатоцитов под влиянием преднизолона сопровождается повышением их резистентности и наоборот.
Через 1 ч действия преднизолона по сравнению с нормой (100%) резистентность изолированных гепатоцитов составляла 140%, репарационная способность - 67%, через 2 ч действия преднизолона - соответственно 68 и 121 %.
Приведенные данные свидетельствуют о том, что особенностью действия преднизолона в указанных условиях является способность повышать репарационные возможности клеток, понижая их устойчивость к механическому повреждению. Выявленная закономерность может также служить критерием отбора веществ на глюкокортикоидную активность.
Вышеизложенное позволяет считать, что одним из приемов отбора и исследования соединений с определенным видом биологической активности является комплексное использование группы биофизических методов исследования, направленных на выяснение механических свойств изолированных клеток при действии известных соединений. Однако такая система поиска веществ по реакциям на клеточном уровне не может полно отражать биологическую активность испытываемых веществ, так как не дает возможности прогнозировать эффекты тестируемых соединений на других информационно значимых для практической медицины уровнях организации: тканевом, органном, системном, организменном.
Простым и эффективным при проведении исследований in vitro с целью тестирования биологически активных веществ является метод культуры тканей, когда используются тканевые фрагменты, сохраняющие структурную организацию и функциональные свойства соответствующих органов. Информация, полученная в таких условиях, позволяет прогнозировать эффекты веществ на уровне целого органа, а в некоторых случаях целой системы (например, пищеварительной по реакциям тканевых фрагментов, полученных из органов пищевого канала).
Для тканевой системы организации однотипных клеток наиболее важной особенностью является образование между их со-прикасающимися поверхностями МК. Установлено, что МК являются стабилизаторами структурной организации тканей и определяют специфику функциональных, особенностей и реактивности тканей при действии физиологических и повреждающих факторов (А. Г. Маленков, 1974; В. И. Архипенко и др., 1975).
Поэтому в качестве критериев поиска и отбора веществ с активностью глюкокортикоидов на тканевом уровне организации в условиях in vitro мы выбрали биофизические показатели состояния МК эпителиоцитов печени: сцепленность клеток друг с другом, способность их к реассоциации и трансэпителиальный транспорт веществ. Особенности изменения состояния МК гепатоцитов при действии преднизолона изучали в экспериментах на 6 белых беспородных крысах-самцах массой 140-160 г. Образцы ткани получали из печени каждого животного и делили на 2 группы: контрольную и подопытную (по 4-6 фрагментов в каждой). Затем образцы инкубировали в среде 199 при 37° С в течение 1-1,5 ч с постоянной аэрацией среды. В подопытной группе в инкубационную среду добавляли преднизолон. Конечная концентрация его в среде для подопытной группы из печени 1-й крысы составила 4⋅10-9 моль; 2-й - 4⋅10-8 моль; 3-й - 4⋅10-7 моль; 4-й - 4⋅10-6 моль; 5-й - 4⋅10-5 моль; 6-й - 4⋅10-4 моль. После инкубации ткани в течение указанного времени ее подвергали дезинтеграции. Обнаружено, что сцепленность гепатоцитов зависит от содержания гормонов в инкубационной среде: преднизолон в концентрации 4⋅10-6 моль повышает, а в концентрации 4⋅10-4 моль снижает сцепленность гепатоцитов соответственно на 62,9% и 68%. В других использованных концентрациях гормон не изменяет сцепленности клеток по сравнению с контролем.
На основании полученных данных для дальнейшего исследования влияния преднизолона на сцепленность клеток печени в зависимости от времени действия гормона мы выбрали следующие концентрации: 4⋅10-4; 4⋅10-6; 4⋅10-8. Опыты проведены на 3 белых беспородных крысах-самцах массой 130-140 г. Получение образцов ткани, условия инкубации и дезинтеграции ткани не отличались от описанных выше. Сцепленность клеток определяли через 2, 3 и 4 ч от начала инкубации. Результаты опытов представлены на рис. 41.
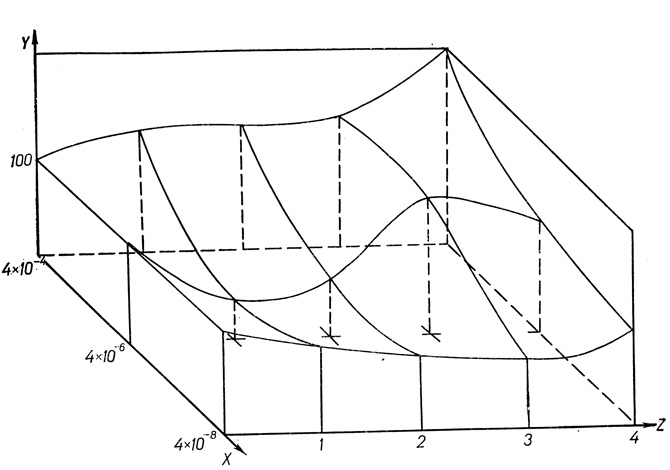
Рис. 41. Зависимость количества отрываемых клеток от дозы и времени действия преднизолона. По оси абсцисс х - доза гормона (в молях), по оси ординат y - количество клеток (в %), z - время действия гормона (в часах)
При инкубации клеток в среде, содержащей 4⋅10-8 моль преднизолона, увеличение сцепленности на 41 % наблюдалось только через 3 ч от начала инкубации. К 4-му часу показатель сцепленности снижен по сравнению с контролем на 37%. Повышение концентрации гормона в среде до 4⋅10-6 моль сопровождается увеличением сцепленности клеток на протяжении первых 2 ч инкубации на 63% и 47% соответственно. При по-следующей инкубации отмечается тенденция к ослаблению сцепленности клеток. Дальнейшее увеличение содержания гормона в инкубационной среде (4⋅10-4 моль) приводит к снижению сцепленности гепатоцитов через 1 и 4 ч контакта ткани с гормоном на 67% и 77% соответственно. После 2 и 3 ч действия гормона показатель сцепленности клеток не отличается от контроля.
Для определения способности гепатоцитов к реассоциации использовано 20 белых беспородных крыс-самцов массой 140-160 г. Способность клеток к реассоциации определяли, как описано выше. Концентрация преднизолона в перфузате составляла 4⋅10-8; 4⋅10-6 и 4⋅10-4 моль.
Установлено, что наиболее выраженным интеграционным эффектом гормон обладает в дозе 4⋅10-6 моль, коэффициент реассоциации клеток (КРК) равен 1,92±0,10. Преднизолон в дозе 4⋅10-4 моль препятствует реассоциации гепатоцитов (КРК = 0,87+0,42). Незначительное восстановление сцепленности клеток отмечается при использовании преднизолона в концентрации 4⋅10-8 моль (КРК = 1,15 ± 0,03).
Представленные данные свидетельствуют о том, что наиболее характерны для преднизолона следующие эффекты: 1) повышение сцепленности гепатоцитов при использовании низких концентраций гормона; 2) фазовое изменение показателя сцепленности при применении физиологических концентраций преднизолона; 3) снижение сцепленности клеток при использовании фармакологических доз гормона. Аналогичная зависимость отмечена при оценке способности гепатоцитов к реассоциации под влиянием преднизолона.
Вышеизложенное позволяет сделать заключение, что влияние глюкокортикоидов на свойства МК in vitro сопровождается зависимым от концентрации и времени действия изменением интегративности клеток в тканевой системе. Особенности изменения исследуемых показателей состояния контактов могут служить критериями отбора биологически активных соединений на глюкокортикоидную активность. Алгоритм поиска критериев от-бора рассмотрен выше при анализе действия преднизолона на резистентность и репарационную способность гепатоцитов. Таким образом, предлагаемая экспериментальная модель, включающая ряд нетрудоемких, эффективных и чувствительных биофизических методов исследования клеточных и тканевых реакций объектов-мишеней, позволяет за короткий промежуток времени отобрать значительное количество биологически активных соединений, обладающих свойствами, присущими глюкокортикоидам. Использование электронновычислительных машин для сравнительного анализа критериев отбора, выбранных в результате тестирования веществ с известной биологической активностью (например, глюкокортикоидов) и соединений, активность которых выявляется, значительно упростит и ускорит производительность системы поиска и отбора.
Чрезвычайно важно для практической медицины выяснить особенности действия исследуемых веществ с помощью выше-описанной экспериментальной модели на уровне организма. Это позволяет сопоставлять результаты опытов in vivo и in vitro и прогнозировать эффекты исследуемых веществ в условиях целостного организма. Выявленные in vivo особенности в измене-нии исследуемых показателей также могут служить критериями отбора испытываемых веществ на биологическую активность.
Мы изучали особенности действия преднизолона на сцепленность гепатоцитов крыс в концентрационно-временном аспекте. Эксперименты проведены на 89 белых беспородных крысах-самцах массой 140-180 г. Животные были распределены на 4 группы. Крысам 1-й группы - контрольной (9 животных) -внутрибрюшинно вводили 0,5 мл физиологического раствора. Животные подопытной группы получали преднизолон в следующих концентрациях на 100 г массы тела: во 2-й группе (23 крысы) - по 0,4 мг; в 3-й группе (36 крыс) - по 2 мг; в 4-й группе (21 крыса)-по 10 мг. Показатель сцепленности гепатоцитов у крыс каждой группы определяли через 3, 6, 12 и 24 ч после введения гормона (рис. 42).
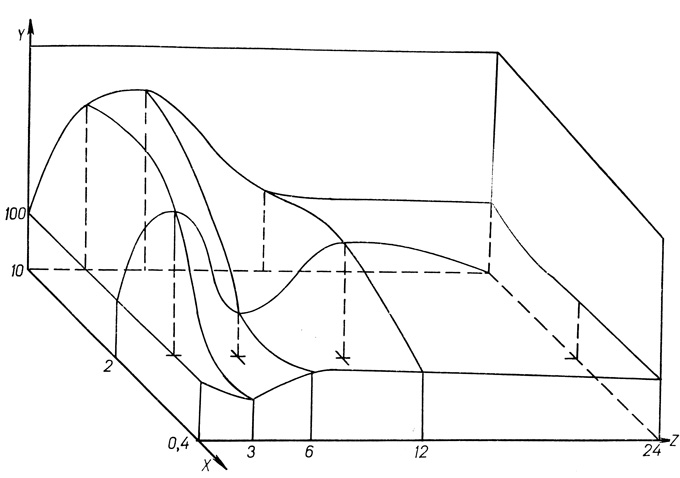
Рис. 42. Зависимость количества отрываемых клеток от дозы и времени действия преднизолона. По оси абсцисс (х) - доза гормона (в мг на 100 г массы тела животного), по оси ординат (у) - количество клеток (в % к контролю), z - время действия гормона (в часах)
Через 3 ч после введения животным гормона в дозе 0,4 мг на 100 г массы тела сцепленность клеток печени увеличивалась на 28%, а через 6, 12, 24 ч действия гормона не отличалась от показателей контрольной группы.
Введение гормона в дозе 2 мг на 100 г массы животного вызывало ослабление сцепленности клеток на 175% через 3 ч после инъекции. К 6 ч действия гормона сцепленность гепатоцитов увеличивалась и на 27,5% превышала данные контрольной группы, через 12 ч после введения преднизолона уменьшалась на 110%, а к 24 ч не отличалась от контроля. Введение гормона в дозе 10 мг на 100 г массы через 3, 6, 12 ч после инъекции сопровождалось ослаблением сцепленности клеток печени на 182%, 270% и 50% соответственно. К 24 ч действия гормона сцепленность гепатоцитов подопытной группы животных не отличалась от контрольной.
При анализе особенностей "поверхности", построенной на основании полученных результатов, установлено, что характер изменения сцепленности гепатоцитов in vivo при использовании различных концентраций преднизолона в динамике действия такой же, как и в экспериментах in vitro.
Морфологические особенности сравниваемых "поверхностей" существенно не отличались. В обоих случаях низкие концентрации преднизолона усиливали, высокие - снижали, а концентрации, соответствующие физиологическим, приводили к фазовому изменению сцепленности клеток печени.
Приведенные данные позволяют считать, что указанные особенности действия глюкокортикоидов на адгезивные свойства МК гепатоцитов проявляются в различных экспериментальных условиях (in vivo и in vitro) аналогичным образом.
Таким образом, использование экспериментальной модели позволило предложить алгоритм поиска биологически активных соединений, обладающих свойствами, характерными для глюкокортикоидов по реакциям клеточной поверхности и МК гепатоцитов ("глюкокортикоидный алгоритм"). Результаты исследования состояния МК гепатоцитов при действии преднизолона in vitro и in vivo в концентрационно-временном аспекте позволяют считать возможным прогнозирование эффектов глюкокортикоидов на уровне целого организма по данным опытов in vitro.
С помощью экспериментальной модели установлено, что действие глюкокортикоидов на органы-мишени является специфичным. Глюкокортикоиды как адаптивные гормоны способствуют развитию -приспособительных реакций на всех уровнях организации (Н. А. Юдаев, 1976). Особенный интерес представляют данные о регуляции защитных свойств эпителиальных тканей - барьеров на пути проникновения повреждающих факторов внешней среды в организм. Барьерные свойства эпителиальных тканей определяются состоянием свободной поверхности эпителиоцитов и МК (В. Т. Ивашкин и др., 1975: H. W. Davenport, 1972). На основании вышеизложенного можно допустить, что глюкокортикоиды способствуют обеспечению резистентности организма при действии стрессора посредством изменения свойств клеточной поверхности и МК эпителиоцитов.
Сведения о структурной организации клеточной поверхности и ее функциональных особенностей имеют значение для понимания физиологической роли поверхности в реакциях клеток и тканевых систем. Большое внимание привлекают работы, посвященные выяснению механизма гормональной регуляции свойств клеточной поверхности клеток-мишеней. Особый интерес представляет изучение роли кортикостероидов как адаптивных гормонов в регуляции свойств клеточной поверхности при действии повреждающих факторов.
Клеточная поверхность имеет решающее значение в сохранении гомеостаза при повреждении (Ю. М. Васильев, А. Г. Маленков, 1968). Под влиянием повреждающих агентов различной этиологии значительно изменяются ее структурные и функциональные особенности (А. Поликар, М. Бесси, 1970; А. П. Авцын, В. А. Шахламов, 1979). Выяснение роли кортикостероидов в изменении свойств клеточной поверхности при повреждении приблизит нас к пониманию путей гормональной регуляции метаболизма клеток в условиях патологии.
Полученные нами данные экспериментов позволяют считать, что при механическом повреждении кортикостероиды в зависимости от условий их применения могут способствовать или препятствовать повреждению клеток.
В опытах in vivo установлено, что однократное (2 мг на 100 г массы тела) и длительное (1 мг на 100 г массы тела ежедневно в течение 3 дней) введение преднизолона вызывает снижение устойчивости изолированных клеток печени к механическому повреждению. Удаление надпочечников также сопровождается снижением резистентности клеток при механическом повреждении.
Резистентность гепатоцитов, по сравнению с контролем (100%) после адреналэктомии составляла 86%, после одноразового введения преднизолона - 49%, после длительного введения преднизолона - 69%. Очевидно, для поддержания оптимального уровня резистентности клеток необходимо определенное содержание кортикостероидов в организме животных. Об этом свидетельствуют результаты экспериментов in vitro (см. рис. 40). Преднизолон, содержащийся в инкубационной среде в низких концентрациях (4⋅10-9, 4⋅10-8 моль), не изменял резистентности клеток. Действие больших концентраций гормона (4⋅10-5, 4⋅10-4 моль) сопровождалось дестабилизирующим эффектом: резистентность гепатоцитов была уменьшена в течение всего периода инкубации клеток и повышалась лишь при использовании гормонов в дозе, соответствующей содержанию кортикостероидов в организме при стрессовых ситуациях (4⋅10-6 моль). Применение преднизолона в концентрации 4⋅10-7 моль (т. е. в пределах колебаний уровня гормонов в организме животных в нормальных условиях) вызывает двухфазное изменение показателя устойчивости гепатоцитов.
Приведенные данные согласуются с представлениями ряда авторов о способности кортикостероидов вызывать стабилизирующий или дестабилизирующий эффект по отношению к различным биологическим мембранам в зависимости от используемой концентрации. Так, Ю. М. Васильев, А. Г. Маленков (1968) приводят работы, в которых сообщается, что кортикостероиды в физиологических концентрациях способны предупреждать на-рушение мембранных структур клеток при действии различных повреждающих факторов. Они считают, что в больших концентрациях кортикостероиды сами вызывают повреждение мембран. Аналогичные данные получены в опытах на эритроцитах при оценке гемолитической активности ряда стероидов (G. Weissman, H. Keiser, 1965; P. M. Seeman, 1966).
Еще не решен вопрос о механизме взаимодействия кортикостероидов с поверхностью клеток. Стероидная природа гормонов позволяет предположить, что наиболее вероятным местом их аппликации и функционирования в пределах биологических мембран является ее гидрофобная область. В пользу этого предположения свидетельствует представление о том, что липиды мембран играют роль растворителя для ряда биологически активных гидрофобных соединений - неполярных аминокислот, жирорастворимых витаминов, стероидных гормонов и др. (С. В. Левин, 1976), По мнению П. В. Сергеева и соавторов (1971), взаимодействие стероидных гормонов с плазмолеммой является наиболее ранним и существенным моментом в механизме их действия. Л. А. Пирузян и соавторы (1974) считают, что стероидные гормоны не обладают первичным мембранотропным эффектом, они проявляют свою специфическую активность внутри клетки, взаимодействуя с рецепторами цитоплазмы и ядра, т. е. стероиды изменяют мембранные функции клеток вторично, опосредованно через изменение внутриклеточного обмена.
В изменении репарационной способности клеточной поверхности при повреждении глюкокортикоиды также играют определяющую роль. Условия существования клеток в организме никогда не бывают идеальными и можно полагать, что клетки эпителиальных тканей всегда подвергаются действию повреждающих факторов. Естественной ответной реакцией клеток при этом является включение механизмов репарации, которые направлены на ликвидацию повреждений, если действие повреждающего фактора не вызвало необратимых изменений, т. е. клетка не перешла еще в состояние так называемой точки невозвращения (B. F. Trump, F. L. Ginn, 1969). В настоящее время достигнуты значительные успехи в изучении репарационных процессов на тканевом, клеточном и субклеточном уровнях (В. В. Александров, 1964; Д. С. Саркисов, 1970; И. Б. Токин, 1974; Д. С. Саркисов и др., 1975). Однако большинство работ выполнено на уровне феноменологии. В литературе имеются лишь отрывочные сведения о способности некоторых веществ изменять репарационные свойства клеток при повреждении (Ю. П. Черненко и др., 1974). Полученные нами экспериментальные данные указывают на способность кортикостероидов изменять репарационные свойства изолированных гепатоцитов при механическом повреждении (В. И. Архипенко и др., 1975). В опытах in vivo репарационная способность гепатоцитов повышается при одноразовом введении "стрессовой" дозы гормона. После воздействия преднизолоном репарационная способность гепатоцитов составляла 127% по сравнению с нормой (100%). В условиях in vitro преднизолон в дозе 4⋅10-7 моль вызывает двухфазное изменение репарационной способности гепатоцитов.
При сопоставлении данных по оценке резистентности и репа-рационной способности клеточной поверхности гепатоцитов в различных экспериментальных условиях (in vivo и in vitro) выявлена следующая особенность в изменении гормонов исследуемых показателей. Ослабление резистентности гепатоцитов под влиянием кортикостероидов сопровождается повышением репарационной способности клеток и наоборот. Можно предположить, что под влиянием гормонов ослабление резистентности клеток, обусловленное изменением функциональных свойств клеточной поверхности, является сигналом для активации внутриклеточных репарационных систем, способствующих адаптации клеток. Об этом свидетельствуют также данные электронномикроскопических исследований. По сравнению с ультраструктурной организацией гепатоцитов интактных животных (рис. 43) в клетках печени животных, подвергшихся воздействию преднизолона, хроматин конденсирован преимущественно на периферии ядра (рис. 44). Митохондрии выглядят набухщими, размеры их увеличены, матрикс значительно просветлен, протяженность крист уменьшена, между отдельными органеллами отмечаются тесные топографические контакты (рис. 45). Существенно возрастает количество мембраносвязанных рибосом и гликогена в цитоплазме клеток (рис. 46). Вышеизложенное свидетельствует об усилении функциональной активности клеток.
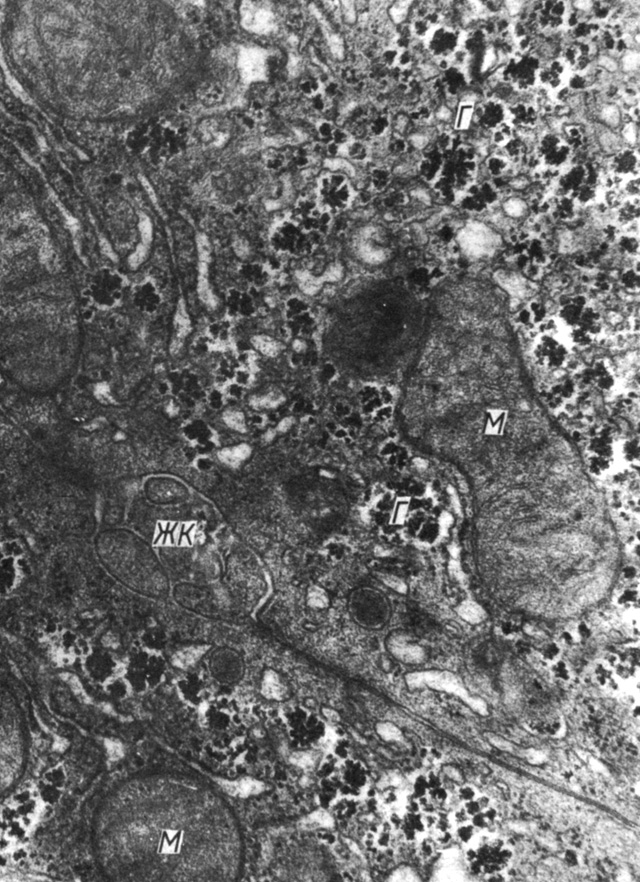
Рис. 43. Гепатоциты интактных животных: ЖК - желчный каналец, М - митохондрия, Г -гликоген. Увеличение 50 000
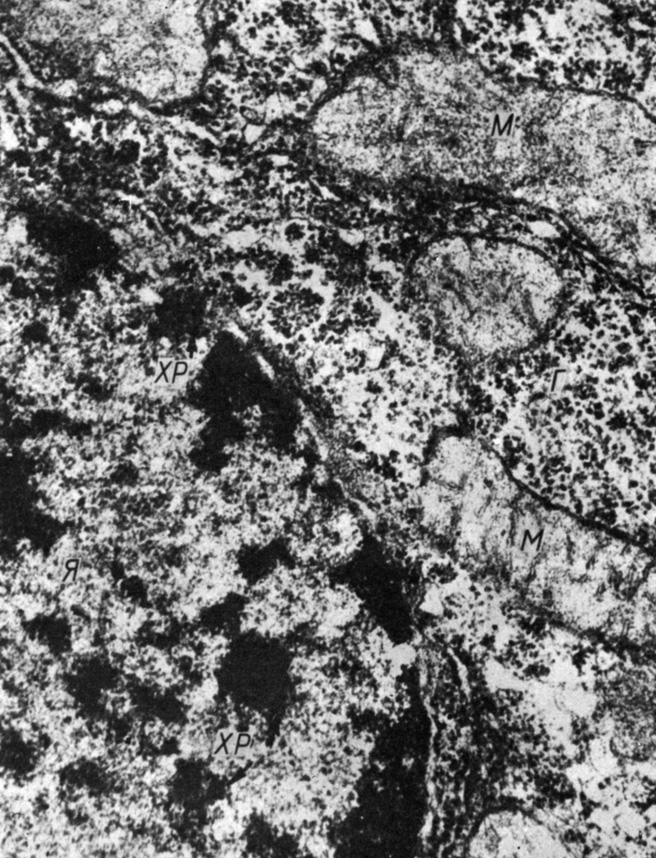
Рис. 44. Гепатодит крысы через 3 ч после введения преднизолона (2 мг/100 г массы): Я - ядро, ХР - хроматин, Г - гликоген. Увеличение 43 000
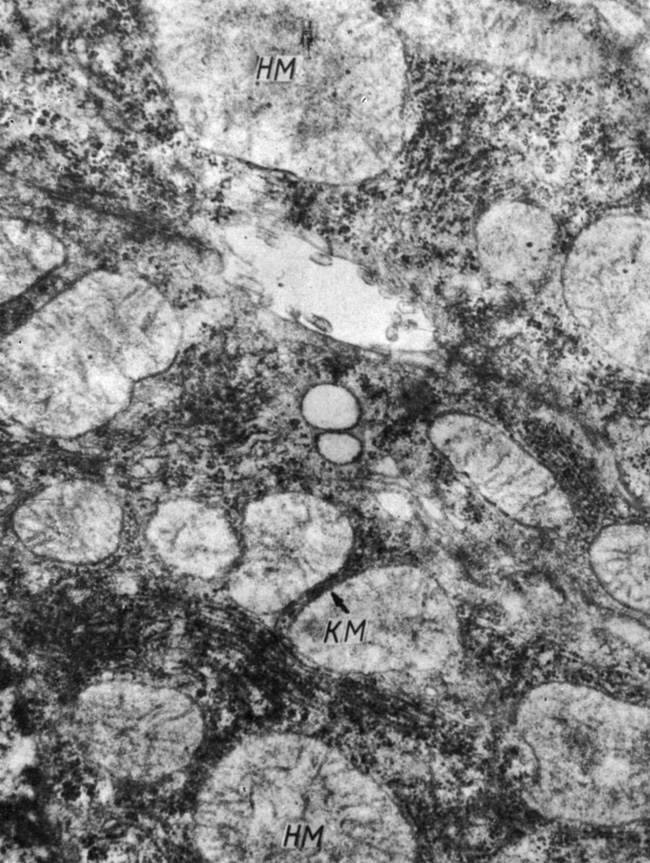
Рис. 45. Гепатоциты крыс через 3 ч после введения преднизолона (2 мг/100 г массы): НМ - набухшие митохондрии, КМ - контакт митохондрий. Увеличение 32 000
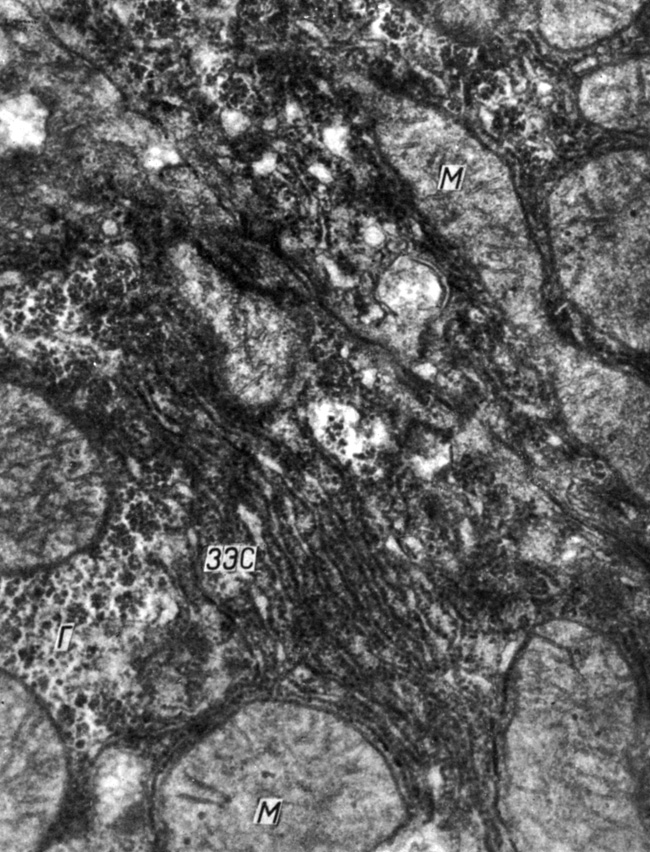
Рис. 46. Гепатоциты крыс через 3 ч после введения преднизолона (2 мг/100 г массы): ЗЭС - зернистая эндоплазматическая сеть, Г - гликоген, М - митохондрии. Увеличение 46 000
Таким образом, кортикостероиды изменяют устойчивость и репарационные свойства поверхности клеток при механическом повреждении. Эффект действия гормонов определяется условиями применения (дозой, временем действия).
Адаптивная роль кортикостероидов проявляется не только в активации процессов адаптации на клеточном уровне (индукция синтеза адаптивных ферментов, изменение резистентности и репарационной способности клеток при действии повреждающих факторов и т. д.); большое значение в приспособительных реакциях организма имеет способность кортикостероидов изменять состояние МК (В. И. Архипенко и др., 1974; Н. А. Чуич, 1975; В. И. Архипенко и др., 1976).
Результаты наших исследований, проведенных в различных экспериментальных условиях (in vivo и in vitro), позволяют заключить, что кортикостероиды изменяют свойства контактов эпителиоцитов, причем воздействующий эффект гормонов определяется его концентрацией в организме животных или в инкубационной среде, а также зависит от времени действия гормона.
Изменение свойств МК под влиянием кортикостероидов является важным признаком изменения функциональных свойств тканевой системы в адаптационных реакциях организма. Представляют интерес данные о способности кортикостероидов в низких концентрациях усиливать интеграцию эпителиоцитов в тканевой системе.
В экспериментах in vivo установлено, что введение преднизолона в дозе 0,4 мг на 100 г массы тела сопровождается повышением сцепленности гепатоцитов через 3 ч после инъекции. Таким же эффектом обладает гормон в низких концентрациях in vitro (4⋅10-8 моль). Очевидно, в условиях мобилизации защитных реакций тканевой системы повышение степени интеграции ее отдельных элементов имеет биологический смысл. Наиболее важное значение в межклеточной интеграции имеют нексусы (N. В. Gilula, 1974). Указанные структуры МК являются своеобразными информационными каналами, посредством которых клетки могут обмениваться содержащимися в них регуляторными молекулами (G. M. Kolodny, 1974; J. D. Sheridan, 1975). По мнению В. П. Божковой и соавторов (1970), такая совокупность клеток должна быть хорошо защищенной от локальных возмущений и ее функционирование должно быть более стабильным, что, вероятно, играет немаловажную роль в условиях адаптации организма.
Можно предположить, что повышение сцепленности эпителиоцитов под влиянием малых доз кортикостероидов обусловлено новообразованием нексусов, необходимых для усиления метаболической интеграции клеток на начальных этапах адаптации. Указанная возможность гормональной индукции новообразования нексусов в МК отмечена при действии эстрогенов на миоциты матки (R. A. Bergman, 1968) и тиреоидных гормонов на эпендимоглиальные контакты (R. C. Decker, 1976) и контакты между клетками щитовидной железы, растущими в культуре (G. Favet и др., 1971). О возможности такого предположения свидетельствует также способность кортикостероидов вызывать образование МК между гепатоцитами, растущими в культуре. Изменение структуры нексусов наблюдалось при действии веществ, обладающих мембранотропной активностью (D. A. Goodenough, J. P. Revel, 1970). Возможно, кортикостероиды способствуют образованию нексусов, изменяя свойства контактных мембран соседних клеток. Это предположение основано на результатах работ, из которых следует, что вещества стероидной природы, в том числе и кортикостероиды, вызывают структурные изменения в плазмолемме различных видов клеток (Е. М. Massa, 1975; B. J. Sedlak, L. J. Gilbert, 1975).
Нексусы устойчивы к различным воздействующим факторам. Данные об устойчивости нексусов при механическом воздействии (P. Emmelot и др., 1970) свидетельствуют о возможности новообразованных структур усиливать механическую связь клеток.
Способность кортикостероидов изменять свойства клеточной поверхности в области МК подтверждается также данными по оценке реассоциации гепатоцитов под влиянием гормонов после предварительного ослабления сцепленности клеток бескальциевой средой.
Преднизолон в низких концентрациях повышает способность гепатоцитов к реассоциации. Это также подтверждает право-мерность предположения о способности кортикостероидов в низких концентрациях усиливать интеграцию эпителиоцитов.
Большой интерес вызывает мнение о способности кортико-стероидов при описанных "интеграционных" условиях повышать барьерные свойства эпителиальных тканей. В наших экспериментах проницаемость брыжейки крыс для метиленового синего при концентрации преднизолона в инкубационной среде 4⋅10-7 моль составляла 67%, при 4⋅10-6 моль - 92%, при 4⋅10-5 моль- 193%, при 4⋅10-4 моль - 350% по сравнению с контролем (100%). Эти данные показывают, что низкие кон-центрации преднизолона при его использовании in vitro препятствуют трансэпителиальному транспорту витальных красителей. Можно предположить, что изменение трансэпителиального транспорта красителя обусловлено способностью гормона изменять функциональные свойства МК мезотелиоцитов, а последнее - их способностью модифицировать структуру плотных соединений.
Мы не исключаем также возможности проявления интеграционного эффекта кортикостероидов посредством индукции синтеза АФ (P. L. Ballard, G. Ь. Tomkins, 1970).
Следовательно, действие кортикостероидов в дозах, не превышающих "стрессовые", проявляется повышением интеграции эпителиоцитов исследуемых тканей, которая выражается увеличением сцепленности и реассоциации клеток, а также уменьшением трансэпителиального транспорта веществ. Можно полагать, что на начальных этапах адаптации организма подобная реакция эпителиальных тканей является защитной, так как происходит повышение метаболической интеграции эпителиоцитов и уменьшение проницаемости эпителиального пласта для повреждающих факторов внешней среды.
Применение в наших исследованиях фармакологических концентраций кортикостероидов (значительно превышающих уровень содержания гормонов при стрессовых реакциях) позволило обнаружить выраженное разобщение эпителиоцитов по всем определяемым показателям в экспериментах in vivo и in vitro. Установлено резкое ослабление сцепленности гепатоцитов, снижение их способности и реассоциации и повышение трансмезотелиального транспорта красителя. Вероятно, кортикостероиды в больших дозах оказывают дестабилизирующее действие на контакты эпителиоцитов, что может быть причиной развития патологических процессов.
Функциональная дезинтеграция клеток может способствовать развитию ареактивности ткани к действию физиологических регуляторов. Так, по данным Л. С. Салямона (1974), в условиях опухолевой трансформации, когда нарушение структуры и функций МК считается общепризнанным (Ю. М. Васильев, А. Г. Маленков, 1968), снижается чувствительность трансформированной ткани к действию биологических регуляторов.
Кроме ослабления сцепленности клеток и повышения трансэпителиального транспорта веществ, кортикостероиды в больших дозах препятствуют реассоциации разобщенных гепатоцитов. Очевидно, это связано со способностью гормонов в указанных условиях нарушать адгезивные свойства контактной поверхности гепатоцитов. На основании вышеизложенного можно сделать заключение, что избыточное содержание кортикостероидов в организме животных способствует выраженному разобщению клеток в эпителиальных тканях.
Использование в наших исследованиях концентраций гормонов, соответствующих содержанию кортикостероидов в организме при стрессовых реакциях (2 мг/100 г массы тела и 4⋅10-6 моль), позволило обнаружить следующие особенности в изменении определяемых показателей. Через 3 ч после введения преднизолона в экспериментах in vivo выявлено значительное снижение адгезии клеток печени.
Ослабление сцепленности гепатоцитов, сопровождающееся их разобщением в системе ткани, свидетельствует об увеличении объема межклеточных пространств, составляющих ультрамикроциркуляторную систему ткани. Посредством этой системы обеспечивается транспорт продуктов обмена из крови к эпителиоцитам и в обратном направлении (И. Б. Токин, 1974; А. М. Чернух, 1976).
Разобщение эпителиоцитов в условиях адаптации организма под влиянием кортикостероидов, вероятно, обусловлено необходимостью повышенного обеспечения клеток питательными веществами и выводом продуктов обмена. Кортикостероиды обеспечивают резистентность организма к действию стрессора посредством повышения активности адаптивных ферментных систем клеток (Т. Н. Протасова, 1969), что, очевидно, требует усиленного притока к ним энергетического и пластического мате-риала. Можно предположить, что в этих условиях разобщение клеток способствует достаточному обеспечению их необходимыми веществами. Однако длительное пребывание клеток эпителия в разобщенном состоянии может служить причиной проникновения повреждающих факторов в организм, если при этом нарушаются барьерные свойства МК. Очевидно, поэтому естественной адаптивной реакцией эпителиоцитов, определямой кортикостероидами, является последующее усиление их интеграции, обнаруженное в наших экспериментах через 6 ч после введения гормона. Подобная реакция эпителиоцитов в условиях адаптации может быть обусловлена индукцией гормоном АФ клеточной поверхности.
Приведенные сведения согласуются с данными других исследователей, показавших фазовый характер изменения адгезивных свойств контактной поверхности эпителиоцитов при стрессовых реакциях (А. М. Чернух, 1976).
Фазность в изменении сцепленности гепатоцитов при действии "стрессовых" доз кортикостероидов, вероятно, в значительной степени определяется свойствами простых соединений МК, площадь которых составляет до 90% всей контактной поверхности эпителиоцитов (D. E. Orwin и др., 1973).
Простые соединения обладают достаточной лабильностью при действии некоторых биологически активных соединений, в том числе и гормонов (В. М. Пинская, 1975; Ю. П. Черненко, 1975). С позиций повышения барьерных свойств эпителиальной ткани в условиях адаптации организма представляет интерес вопрос о корреляции сцепленности эпителиоцитов с изменением барьерных свойств ткани.
Результаты исследования трансэпителиального транспорта веществ в печени показывают, что с ослаблением сцепленности гепатоцитов под влиянием преднизолона проницаемость желчи через межклеточное пространство не увеличивается. Напротив, обнаружено снижение интенсивности и скорости трансфузии индикатора проницаемости через гемато-билиарный барьер (рис. 47). Следовательно, кортикостероиды в "стрессовых" дозах на ранних этапах действия, наряду с разобщением тканевой системы, с целью улучшения притока питательных веществ не нарушают барьерную функцию эпителия и предупреждают прохождение повреждающих веществ через эпителий. Возможно, в этих условиях действие кортикостероидов проявляется изменением функциональной активности специализированных структур МК: дестабилизацией простых соединений и нексусов и стабилизацией плотных соединений. Для проверки этого предположения нами проведено электронномикроскопическое исследование ультраструктуры МК гепатоцитов в условиях, когда преднизолон ослабляет сцепленность клеток и препятствует транспорту желчи из желчных капилляров в кровеносную систему печени (В. П. Колотенко, 1977).
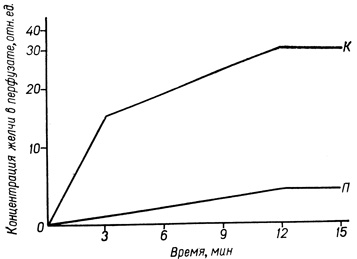
Рис. 47. Влияние преднизолона на трансэпителиальный транспорт желчи в печени крыс: К - контроль, П - введение преднизолона. По оси абсцисс - время перфузии (в минутах), по оси ординат - концентрация желчи в перфузате (в отн. ед.)
Введение животным преднизолона не вызывает существенных изменений структуры МК. Вероятно, функциональные изменения контактов при указанных условиях действия гормона не сопровождаются изменением структуры специализированных соединений, доступным для выявления методом электронной микроскопии. Поэтому для проявления механических свойств специализированных соединений контакта мы использовали действие гидродинамического "клина", способствующее механическому разрушению указанных соединений. Установлено, что после введения животным преднизолона в условиях действия гидродинамического "клина" существенно изменяются простые соединения. Плотные соединения нексусы в этих условиях сохраняют структуру, характерную для контактов контрольных животных. Наряду с этим преднизолон в значительной степени препятствует повреждению цитоплазматических структур клеток в организме.
На основании вышеизложенного можно утверждать, что кортикостероиды в концентрациях, близких к "стрессовым", могут способствовать или препятствовать дезинтеграции эпителиоцитов в зависимости от времени действия гормона. Особенностью действия кортикостероидов является их способность в условиях механического разобщения ткани сохранять метаболическую интеграцию эпителиоцитов и повышать барьерные свойства эпителия. Это, очевидно, обусловлено избирательным влиянием кортикостероидов на специализированные структуры МК. Наряду с изменением свойств МК кортикостероиды предупреждают развитие внутриклеточных дегенеративных процессов, повышая репарационные свойства эпителиоцитов.
Таким образом, вышеизложенный метод отбора веществ, обладающих глюкокортикоидной активностью, может быть применен при испытании природных и синтетических соединений на биологическую активность. Разработанная экспериментальная модель позволяет получить новые данные о механизме действия тестируемых соединений на субклеточном, клеточном и тканевом уровнях организации, которые необходимы для создания их классификации.
Открытие путей использования результатов, полученных в эксперименте, в практической медицине значительно зависит от улучшения взаимопонимания между экспериментаторами и клиницистами.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'