
Ультраструктура вставочных дисков сердечных миоцитов при функциональных нагрузках миокарда (Дзяк Г. В, Черненко Ю. П.)
Вставочные диски представляют собой сложные структуры, образованные контактирующими поверхностями соседних сердечных миоцитов. Вставочные диски позвоночных состоят из контактных элементов: простых соединений, фасций слипания; десмосом и щелевых соединений, нексусов (О. Я. Морозова, 1975; D. W. Fawcett, N. S. McNutt, 1969; J. R. Sommer, E. A., JohnSon, 1970; A. Matter, 1973; D. J. Arluk, J. A. G. Rhodin, 1974; N. S. McNutt, 1975). С помощью такого набора соединений каждый сердечный миоцит "подключен" к соседним клеткам. В процессе жизнедеятельности миокарда вставочные диски подвергаются постоянным механическим нагрузкам, возникающим при сокращении миоцитов. Синхронизация сокращения миоцитов осуществляется посредством щелевых соединений, связывающих соседние миоциты (К. Goshima, 1970; N. S. McNutt, 1975). Вставочные диски можно рассматривать как удобные объекты для изучения адгезивной и коммуникативной функций МК.
Структура и функция МК зависят от характера жизнедеятельности контактирующих клеток. Возникающие изменения ультраструктуры и свойств контактов при нарушениях клеточного метаболизма приводят к изменениям свойств и реакций ткани. В связи с этим актуальной задачей является исследование ультраструктуры и свойств вставочных дисков при функциональных нагрузках и перегрузках миокарда и его гипертрофии.
Мы исследовали ультраструктуру вставочных дисков при гемодинамических перегрузках миокарда с последующей его гипертрофией. Эксперименты проведены на 96 белых беспородных крысах массой 200-250 г. Для моделирования функциональных нагрузок на миокард и развития его гипертрофии производили стенозирование 2/3 просвета аорты. Через 1, 2, 3, 4, 5, и 6 мес после наложения стеноза и через 1, 2, 3 и 4 мес после снятия его (после 6-месячного стенозирования аорты) проводили электронномикроскопическое исследование миокарда. В качестве контроля использовали миокард интактных животных.
Рассмотрим особенности ультраструктурной организации вставочных дисков в миокарде интактных крыс. На ультратонких срезах миокарда правого и левого желудочков протяженность простых соединений достигает 1-3 мкм, межмембранные пространства этих соединений шириной 20-30 нм заполнены незначительно структурированным содержимым с низкой электронной плотностью. Встречаются участки расширения мембранных пространств до 50 нм протяженностью 0,3-0,6 мкм. Основной функцией этих соединений является транспорт веществ между миоцитами вдоль вставочных дисков.
В правом и левом желудочках миоциты связаны обширными фасциями слипания. Протяженность их может достигать нескольких микрометров. С цитоплазматической стороны к мембранам фасций слипания прилежат участки, образованные скоплением микрофиламентов (филаментозные маты). Фасции слипания имеют извилистые контуры, плазмолеммы в этих областях часто образуют интердигитации. Функция фасций слипания заключается в поддержании определенной величины адгезивной связи между контактирующими миоцитами. Кроме того, фасции слипания являются местами прикрепления актиновых филаментов миофибрилл миоцитов. Во время сокращения в областях фасций слипания развивается максимальное напряжение (О. Л. Морозова, 1975).
Десмосомы имеют типичную ультраструктуру. Их плазмолеммы установлены относительно друг друга на расстоянии 25- 30 нм. Межмембранное пространство заполнено филаментозным содержимым и разделено центральной электронноплотной линией толщиной 4-5 нм. В плоскости контакта миоцитов десмосомы представляют собой дисковидные структуры. Длина десмосомы составляет 50-100 нм. С цитоплазматической стороны к плазмолеммам десмосом прилежат электронноплотные пластинки толщиной 10-15 нм, к пластинкам прикреплены тонофиламенты диаметром 10 нм. Пучки тонофиламентов могут связывать соседние десмосомы либо уходить в цитоплазму миоцитов (рис. 48). Десмосомы выполняют адгезивную функцию, поддерживая механическую связь между контактирующими миоцитами. Тонофиламенты десмосом и десмосомные пластинки играют роль механических протекторов, препятствующих деформации миоцитов при их сокращениях (L. A. Staehelin, 1974).
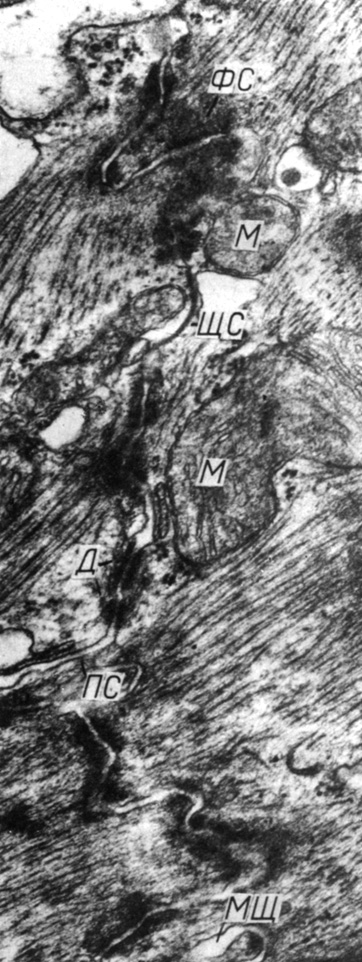
Рис. 48. Фрагмент вставочного диска между контактирующими миоцитами миокарда левого желудочка. Обозначения здесь и дальше: ФС - фасция слипания, Д - десмосома, ЩС - щелевое соединение, ПС - простое соединение, МЩ - межклеточные щели, М - митохондрия. Увеличение 38 000
Щелевые соединения обнаруживаются на ультратонких срезах вставочных дисков. Длина их достигает 1,5 мкм, ширина межмембранного пространства составляет 2,5-3,5 нм (рис. 49). Поддерживая ионные связи между контактирующими миоцитами, щелевые соединения обеспечивают сохранение электротонических связей между миоцитами, передачу возбуждения от миоцита к миоциту и синхронизацию их сокращений.
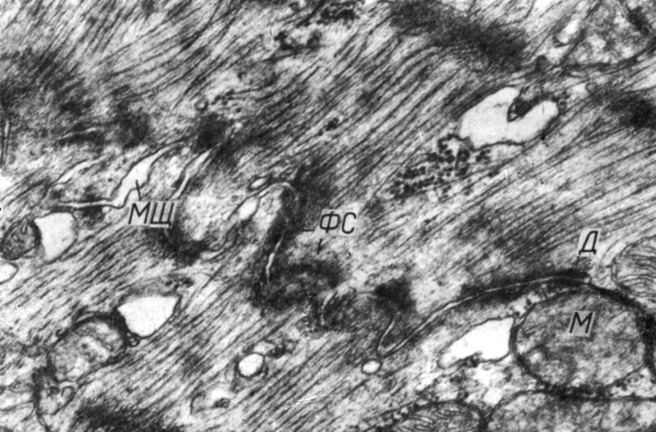
Рис. 49. Область вставочного диска между контактирующими миоцитами правого желудочка. Увеличение 36 000
Большой интерес вызывает взаиморасположение отдельных контактных элементов вставочных дисков и органоидов миоцитов. С цитоплазматической стороны к мембранам вставочных дисков за исключением фасций слипания, прилежат митохондрии, канальцы L-системы, гладкостенные пузырьки диаметром до 40-60 нм. Области щелевых соединений обычно свободны от прилежащих к ним органоидов, здесь обнаруживаются цистерны L-системы и прилежащие к ним канальцы Т-системы.
После наложения стеноза аорты в течение первых 3 мес развивается гипертрофия миокарда, что сопровождается нарушениями ультраструктурной организации вставочных дисков и миоцитов. Через 1 мес после наложения стеноза аорты в миокарде левого желудочка в областях простых соединений появляются участки расширения межмембранных пространств, межклеточные щели или полости длиной до 1 мкм, шириной до 0,4 мкм. В областях фасций слипания межмембранные пространства увеличиваются до 60-90 нм (рис. 50). Значительно возрастает количество интердигитаций в этих участках. Десмосомы сохранены. Обнаруживаются щелевые соединения, к которым с обеих сторон симметрично прилежат митохондрии, такие структуры получили название митохондриально-нексусных комплексов.
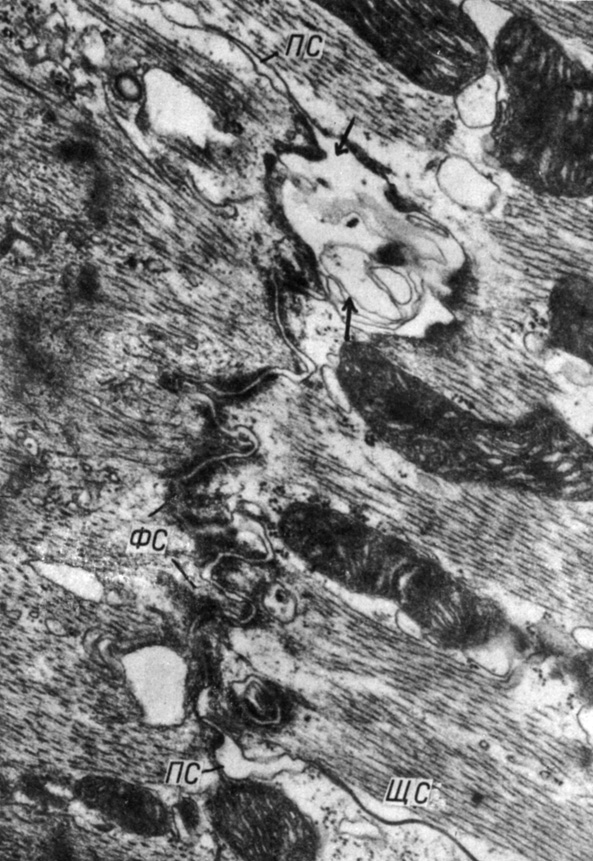
Рис. 50. Участок вставочного диска в миокарде левого желудочка через 1 мес после наложения стеноза аорты. Колбовидное расширение в области фасции слипания (стрелки). Увеличение 32 000
В правом желудочке через 1 мес после наложения стеноза аорты изменения в ультраструктуре вставочных дисков более выражены. В областях фасций слипания видны колбовидные расширения межмембранного пространства. Участки расширения достигают длины 3 мкм и ширины 0,5 мкм. Встречаются вставочные диски, где фасции слипания разрушены, вместо них видны широкие межклеточные щели, заполненные цитоплазматическими микровыростами (рис. 51). В областях прикрепления актиновых филаментов к филаментам фасций слипания наблюдаются участки просветления, где нарушается нормальная связь актиновых филаментов с филаментозными матами фасций слипания.
В пределах одного вставочного диска можно выявить участки фасции слипания, имеющие нарушенную и близкую к нормальной ультраструктуру. Колбовидные расширения межмембранных пространств наблюдаются также и в участках простых соединений. Щелевые соединения и десмосомы сохранены. Количество щелевых соединений увеличивается от 2 до 5 в области сечения одного вставочного диска, протяженность их достигает 2,5 мкм (см. рис. 51).
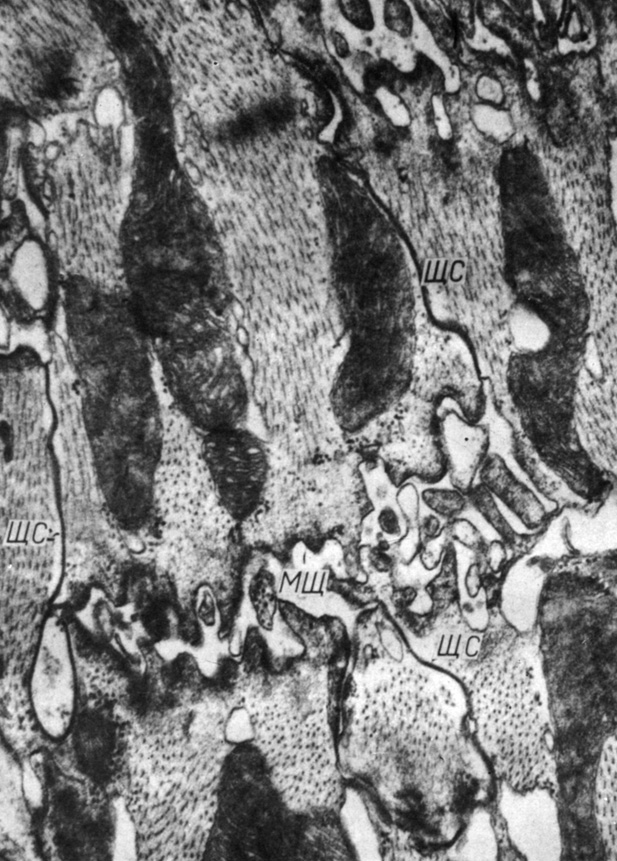
Рис. 51. Разрушенные фасции слипания между миоцитами правого желудочка. Образовавшиеся межклеточные щели заполнены цитоплазматическими микровыростами; миоциты связаны обширными щелевыми соединениями. Увеличение 38 000
Наряду с нарушениями ультраструктурной организации вставочных дисков в цитоплазме миоцитов возникают изменения, свидетельствующие о развитии дистрофических и деструктивных процессов: расширение канальцев Т- и L-систем, гипертрофия, набухание и деструкция митохондрий, обводнение цитоплазмы миоцитов, дезорганизация сократительной системы. Деструктивные процессы более выражены в миоцитах левого желудочка.
Через 2-4 мес после наложения стеноза аорты изменения ультраструктуры миоцитов и вставочных дисков становятся менее выраженными и более гетерогенными. Наряду со вставочными дисками с измененной ультраструктурой (что проявляется наличием широких межклеточных щелей в областях фасций слипания и простых соединений) отмечаются вставочные диски с нормальной ультраструктурой. Протяженность щелевых соединений больше, чем в интактном миокарде, длина их достигает 2,5 мкм. В сохранившихся участках фасций слипания увеличивается число интердигитаций (рис. 52).
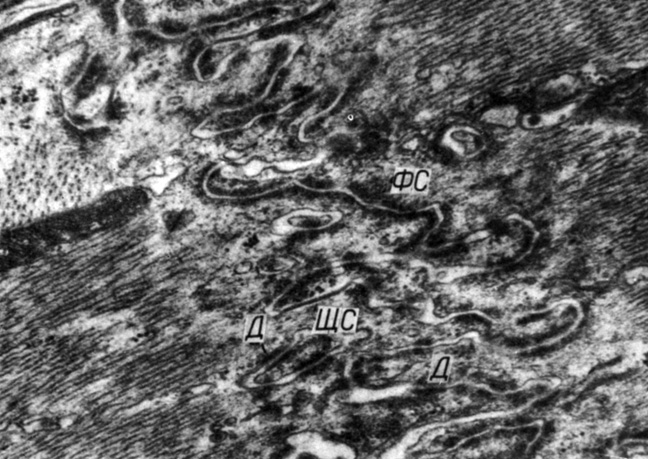
Рис. 52. Увеличение числа интердигитадий в участках фасций слипания через 3 мес после наложения стеноза аорты. Увеличение 29 000
К 5-му месяцу стеноза в левом и правом желудочках сердца ультраструктура вставочных дисков и миоцитов частично нормализуется. Сохраняются большие размеры щелевых соединений. Обнаруживаются митохондриально-нексусные комплексы (рис. 53).
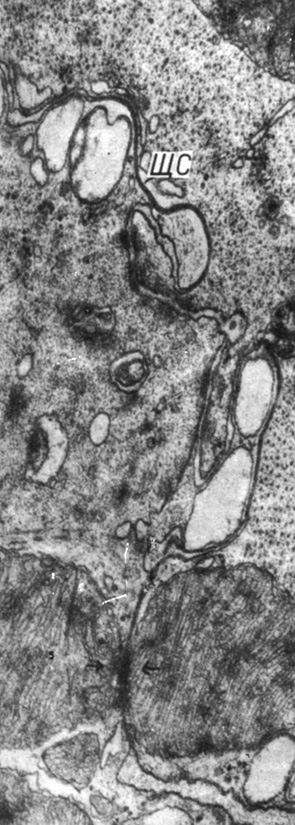
Рис. 53. Митохондриально-нексусный комплекс в области вставочного диска в миокарде правого желудочка через 4 мес после наложения стеноза (стрелки). Увеличение 31 000
Через 6 мес после наложения стеноза структура вставочных дисков полностью не нормализуется, их ультраструктура остается гетерогенной. Наряду со вставочными дисками, имеющими нормальную структуру, встречаются вставочные диски с выраженными расширениями межмембранных пространств в местах фасций слипания и простых соединений (рис. 54). Десмосомы и щелевые соединения сохранены. Обнаруживаются щелевые соединения, протяженность которых достигает 2,5 мкм. Ультраструктурные изменения миоцитов указывают на то, что клетки продолжают работать в повышенном функциональном режиме. Об этом свидетельствуют наличие гипертрофированных и частично набухших митохондрий, расширение отдельных канальцев Т- и L-систем.
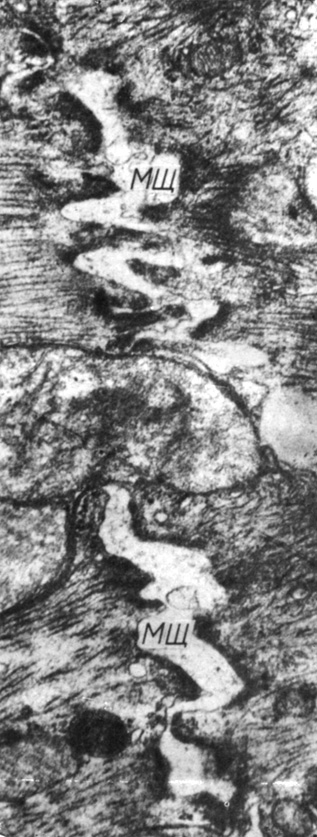
Рис. 54. Расширения межмембранных пространств фасций слипания в миокарде правого желудочка через 5 мес после наложения стеноза аорты. В нарушенных участках вставочных дисков миоциты разделены межклеточными щелями. Увеличение 36 000
Таким образом, к концу исследованного периода стеноза аорты мы не наблюдали нормализации ультраструктурной организации миоцитов и их контактных взаимоотношений.
Через 1 мес после снятия стеноза в миоцитах и вставочных дисках развиваются изменения, аналогичные начальному периоду после наложения стеноза аорты. Во вставочных дисках в миокарде правого желудочка расширены межмембранные пространства простых соединений, образовавшиеся межклеточные полости местами заполнены цитоплазматическими выростами. Межмембранные пространства фасций слипания расширены. Десмосомы сохранены. Часто непосредственно за десмосомами наблюдаются участки резкого расширения межмембранных пространств простых соединений. Щелевые соединения сохранены, однако протяженность их не превышает 1-1,5 мкм. В цитоплазме миоцитов обнаруживается большое количество плотно упакованных митохондрий. Митохондрии гипертрофированы и содержат большое количество крист. Наблюдаются митохондрии, симметрично расположенные относительно простых соединений. Расширены канальцы L-системы.
В левом желудочке через 1 мес после снятия стеноза отмечаются незначительные изменения ультраструктуры вставочных дисков наряду с выраженными деструктивными процессами в миоцитах. Так, для вставочных дисков характерно наличие расширений до 60 нм межмембранных пространств в областях простых соединений и отдельных фасций слипания (рис. 55). Обращенные друг к другу боковые поверхности миоцитов формируют дополнительные контактные структуры: щелевые соединения, фасции слипания, десмосомы. Наряду с этим для цитоплазмы миоцитов характерно наличие митохондрий с полностью деструктированным матриксом и кристами, такие митохондрии выглядят как большие вакуоли. Встречаются резко гипертрофированные митохондрии и митохондрии с очагами деструкции. Объем деструктивных изменений в левом желудочке через 1 мес после снятия стеноза аорты значительно больше, чем в правом желудочке.
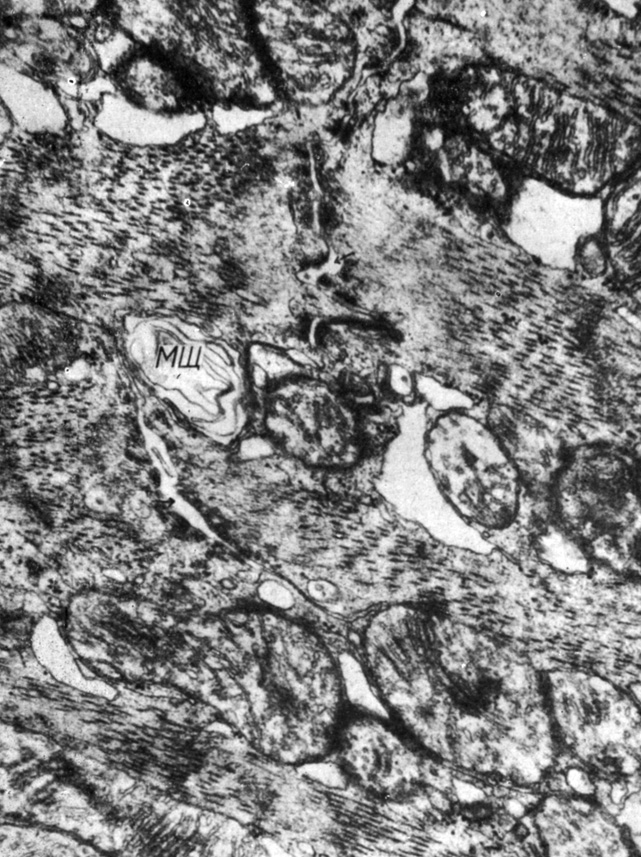
Рис. 55. Колбовидно расширенное межмембранное пространство в участке простого соединения, умеренно выраженное расширение межмембранного пространства в области фасций слипания (стрелки). Увеличение 36 000
Через 2 мес после снятия стеноза частично нормализуется ультраструктура миоцитов и вставочных дисков. Однако ультра-структура миокарда в правом и левом желудочках еще остается гетерогенной. Наряду с миоцитами, имеющими нормальную структуру, выявляются клетки, состояние которых свидетельствует об их функциональной перегрузке: расширенные канальцы L-системы, наличие набухших, гипертрофированных митохондрий, дезорганизация сократительной системы.
Во вставочных дисках миокарда правого желудочка сохраняются участки значительного расширения межмембранных пространств в простых соединениях и фасциях слипания. Протяженность щелевых соединений увеличивается до 2-2,5 мкм. Часто наблюдаются митохондрии, симметрично расположенные относительно щелевых соединений (рис. 56).
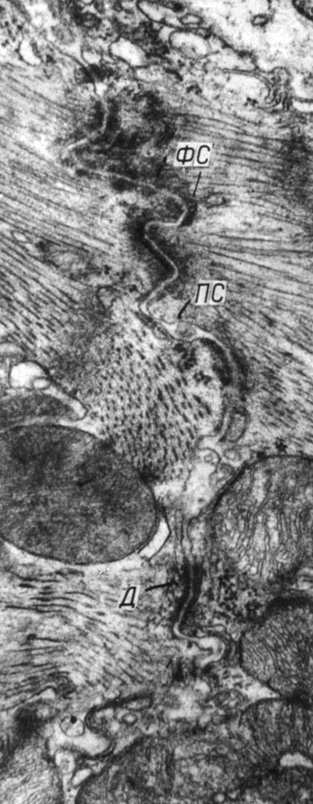
Рис. 56. Митохондрии, симметрично расположенные относительно щелевого соединения. Увеличение 36 000
Через 3 мес после снятия стеноза аорты ультраструктура миоцитов в правом и левом желудочках не отличается от миокарда интактных животных. Однако во вставочных дисках размеры щелевых соединений еще увеличены (рис. 57).
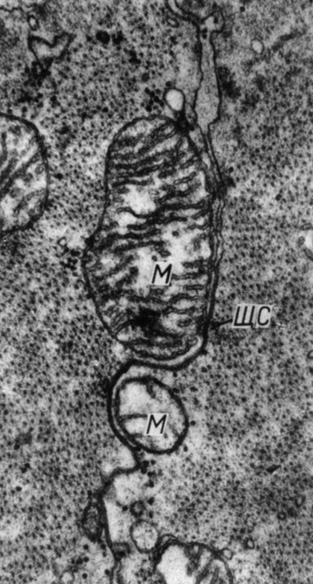
Рис. 57. Ультраструктура вставочного диска в миокарде левого желудочка через 2 мес после снятия стеноза аорты. Увеличение 38 000
Через 4 мес после снятия стеноза ультраструктурная организация миоцитов и вставочных дисков в миокарде правого и левого желудочков нормализуется и не отличается от таковой у интактных животных.
Полученные результаты показывают, что формирование гипертрофии миокарда у крыс с экспериментальным стенозом аорты сопровождается нарушениями ультраструктуры сердечных миоцитов и их контактных взаимоотношений. Характер изменения ультраструктуры миоцитов через 1 мес после наложения стеноза свидетельствует о преобладании деструктивных процессов над восстановительными. Дистрофические и деструктивные процессы в миоцитах, наблюдаемые на ранних сроках развития гипертрофии миокарда, являются результатом гемодинамических перегрузок миокарда и функциональных перегрузок миоцитов (Д. С. Саркисов, Б. В. Втюрин, 1969). Во вставочных дисках при этом обнаруживаются расширения межмембранных пространств простых соединений и фасций слипания, что приводит к образованию между миоцитами широких межклеточных щелей. Вставочные диски и в первую очередь фасции слипания постоянно подвергаются механическим нагрузкам, поэтому очевидно, что такие изменения адгезивных свойств вставочных дисков должны значительно снижать сократительную способность миокарда. Однако наряду с этим ряд изменений в структуре вставочных дисков можно отнести к компенсаторным. Так, в сохранившихся участках фасций слипания значительно увеличено число интердигитаций, увеличивается количество и протяженность щелевых соединений, появляются митохондриально-нексусные комплексы. Эти изменения можно рассматривать как морфологические эквиваленты возрастания адгезивности в сохранившихся областях вставочных дисков и увеличения объема метаболической связи между миоцитами. В пределах одного вставочного диска могут встречаться расширенные и почти неизмененные участки фасций слипания, это позволяет предположить существование двух типов фасций слипания: высоко- и низкоадгезивных.
В последующие сроки формирования гипертрофии миокарда частично нормализуется ультраструктура миоцитов и вставочных дисков, что свидетельствует о приспособлении миокарда к гемодинамическим нагрузкам. К концу исследованного периода деструктивные и дистрофические процессы в цитоплазме миоцитов минимально выражены, т. е. темп восстановительных процессов преобладает над темпом деструктивных. Наличие гигантских митохондрий в цитоплазме миоцитов отражает их возросший энергетический метаболизм. В поздние сроки гипертрофии миокарда наряду с нормализацией ультраструктуры миоцитов интенсивность окислительного фосфорилирования в них повышена по сравнению с интактными миоцитами (А. Н. Пашков, 1975; Ф. 3. Меерсон, 1976). В состоянии приспособления миокарда к гемодинамическим нагрузкам миоциты продолжают функционировать в. повышенном режиме. К концу исследованного периода гипертрофии миокарда ультраструктура вставочных дисков не нормализуется. Сохраняются выраженные расширения межмембранных пространств в участках простых соединений и фасций слипания. Можно полагать, что нарушение отдельных фасций слипания приводит к "выключению" части миофибрилл миоцитов и является одной из причин снижения сократительной способности миокарда. Очевидно, нарушения контактных взаимоотношений миоцитов в гипертрофированном миокарде - одна из основных причин, приводящих к декомпенсации сердца.
После снятия стеноза аорты в процессе восстановления миокарда периоду нормализации ультраструктуры миоцитов предшествует этап нарушения их ультраструктурной организации. Через 1 мес после снятия стеноза аорты в цитоплазме миоцитов обнаруживаются выраженные деструктивные изменения, являющиеся результатом метаболических и функциональных перестроек миокарда к резко уменьшенной нагрузке. Эти данные согласуются с результатами наблюдений у больных после корригирующих операций по поводу пороков сердца (В. И. Бураковский и др., 1972; М. В. Даниленко, В. Т. Бабляк, 1972). Изменения в ультраструктуре вставочных дисков менее выражены, чем через 1 месяц после наложения стеноза.
Через 2 мес после снятия стеноза аорты ультраструктура миоцитов и вставочных дисков нормализуется. Процессы нормализации более выражены в правом желудочке. Через 3 мес миокард имеет практически нормальную ультраструктуру. В некоторых миоцитах обнаруживаются незначительно выраженные дистрофические изменения. К концу 4-го месяца миокард имеет интактную структуру, что позволяет считать этот срок окончанием восстановительного периода.
Таким образом, изменение функциональных режимов работы миокарда сопровождается нарушениями контактных взаимоотношений миоцитов. Нарушения или перестройки ультраструктуры вставочных дисков можно рассматривать как морфологические эквиваленты изменения их свойств: коммуникативных, адгезивных, транспортных. Очевидно, что длительные функциональные перегрузки миоцитов приводят к нарушению структуры вставочных дисков, а это вызывает изменение свойств и реакций миокарда в целом.
Опухолевый процесс и состояние межклеточных контактов (Архипенко В. И., Рогоза Н. С.)
На протяжении значительного времени ученые исследовали изменения МК при бластомогенезе (M. Abercrombie и др., 1957; G. Weiss, 1967; Ю. М. Васильев, А. Г. Маленков, 1968; А. Г. Маленков, 1976). Основываясь на данных электронной микроскопии, различные авторы изучили состояние отдельных элементов МК на значительном клиническом и экспериментальном материале. Результаты этих исследований представлены в работе R. S. Weinstein и др. (1976). Обнаружена выраженная корреляция между отдельными этапами бластомогенеза и характером изменений свойств МК. Высказан ряд гипотез, с помощью которых авторы пытаются объяснить особенности поведения опухолей изменениями в структуре и функциях МК. К таким особенностям относят автономность размножения опухолевых клеток, их способность к инвазии и метастазированию. Однако в настоящее время еще нельзя сделать корректных обобщений по изучению изменений свойств МК при бластомогенезе. Это обусловлено рядом причин. Большинство исследований выполнено на небольшом числе объектов, которые не охватывают основные типы опухолей (особенно мало изучены изменения в состоянии МК при экспериментальном бластомогенезе в условиях in vivo и в опухолях человека), и даже в этих объектах состояние МК изучалось односторонне - применялись традиционные методики. В результате этого, например, многократно и подробно описаны особенности динамического поведения опухолевых клеток соединительнотканного генеза, но почти не изучены механические свойства МК клеток этих опухолей.
У гепатом динамические свойства поверхности и МК мало исследованы, а адгезивные характеристики опухолевых клеток обстоятельно изучены. Почти ни для одного объекта не исследованы репарационные свойства МК и клеточной поверхности.
Изменения свойств МК играют определенную роль в процессах опухолевой трансформации клеток. О первичности или вторичности этих изменений на этапах трансформации у ученых еще нет единого мнения. Согласно одним представлениям, опухолеродный фактор вначале взаимодействует с клеточной поверхностью, изменяя ее свойства, затем приводит к изменениям свойств внутриклеточных структур, в том числе и генетических. Согласно другим представлениям, действие опухолеродного фактора в первую очередь изменяет состояние генетических структур, что приводит к изменению свойств клеточной поверхности и МК, как результат реализации новых свойств генома, индуцированных опухолевой трансформацией. По нашему мнению, вторая точка зрения более обоснованна.
С помощью микроманипулятора D. R. Coman (1944) впервые обнаружил ослабление сцепленности у опухолевых клеток по сравнению с нормальными. Последнее могло свидетельствовать о нарушении свойств МК и клеточной поверхности у опухолевых клеток. Позднее было установлено, что прочность прилипания опухолевых клеток к стеклу в условиях in vitro выше, чем нормальных (L. Weiss, 1969). Используя метод Комана, А. Г. Маленков, Е. В. Штамм (1965) на модели быстрорастущей гепатомы (гепатома 22-а) показали, что клетки этой гепатомы имеют величину сцепления друг с другом на один порядок ниже, чем нормальные гепатоциты. Клетки медленнорастущих гепатом (штаммы 46, 48, 49) по этому параметру не отличались от гепатоцитов нормальной печени.
Изучение методом диспергирования подтвердило результаты, полученные с помощью метода Комана, и позволило выявить более тонкие различия в МК, проявляющиеся на более ранних этапах опухолевой прогрессии. Было обнаружено, что из нормальной печени и медленнорастущих гепатом (штаммы 46, 48, 49, 60 и 61) выделяется очень мало клеток. Однако после кратковременной икубации без Са++ из нормальной печени также выделяется мало клеток, а из опухолевой - на порядок больше. Следовательно, у доброкачественных перевиваемых опухолей нарушена стабильность МК. При диспергировании злокачественной гепатомы 22-а вся опухоль сразу распадается на клеточные комплексы. О нарушении свойств опухолевых клеток и ослаблении величины сцепленности свидетельствуют данные об утрате опухолевыми клетками в условиях культивирования in vitro способности к контактному торможению. При встрече с подобными себе клетками они не образуют устойчивых МК и наползают друг на друга. В наибольшей мере утрачивают способность к сцеплению опухолевые линии, растущие в суспензированной среде или агаре. Нарушение контактных взаимодействий клеток при трансформации эпителиальных опухолей (гепатомы) показано в работе В. И. Гельштейн, Г. Я. Яворской (1964). При сравнении различных по этому признаку штаммов гепатом ими отмечено, что по мере нарастания степени анаплазии нарушается правильность построения эпителиального пласта, появляется многослойность и изоляция групп клеток при эксплантации гепатом в культуральную среду.
Изучение состояния коммуникативной функции МК опухолевых клеток не позволило создать общих представлений по этому вопросу. Согласно данным J. S. Fentirna и соавторов (1977), культивируемые клетки рака молочной железы человека утрачивают способность МК к специфическим коммуникациям. Е. С. Снегиревская и соавторы (1979) использовали хлористый лантан и обнаружили увеличение количества контактов типа нексус и резкое повышение диффузионного обмена флуоресцентной метки в культуре L-клеток.
Существует мнение, что одной из причин, вызывающей уменьшение величины сцепленности в опухолях, может быть увеличение плотности электрического заряда на поверхности мембран в области МК. Это подтверждается данными о том, что у ряда опухолевых штаммов по сравнению с нормальными клетками увеличена электрофоретическая подвижность вследствие повышения концентрации сиаловых кислот на поверхности клеток. Снижение величины сцепленности может быть обусловлено уменьшением содержания Ca в структурах МК. Э. Каудри (1955) отмечено резкое уменьшение концентрации Ca в эпидермальных опухолях по сравнению с нормальным эпидермисом. Высказанному выше предположению противоречат данные о более высоком содержании Ca в гепатомах, чем в нормальной печени. Для решения этого вопроса необходима разработка методик определения количества Ca на поверхности клеток и особенно в области МК.
При жидкостной дезинтеграции клеток солидной гепатомы 22-а с помощью гомогенизатора с последующим суспензированием в физиологическом растворе обнаружено, что число клеток, лизируемых трипсином, и клеток, поверхность которых проницаема для белка, примерно вдвое ниже, чем клеток печени нормальных мышей (А. Г. Маленков, Е. А. Модянова, 1968). По мнению авторов, лизируемость выделенных трипсином клеток обусловлена разобщением клеток и обнажением проницаемой для белка поверхности контакта. Меньшая степень лизируемости клеток солидной гепатомы 22-а по сравнению с клетками нормальной печени может свидетельствовать о более высокой устойчивости и репарационной способности поверхности гепатоцитов в области МК, обусловленной опухолевой трансформацией. Высокая регенераторная способность поверхности клеток, по-видимому, лучше обеспечивает в опухоли сохранение способности ее клеток к метастазированию. Это подтверждают данные Н. С. Роговой (1975), которая установила, что репарационная способность гепатоцитов резко повышается по сравнению с контролем к моменту выхода индуцируемых канцерогеном гепатом.
О возможности возникновения разобщения клеток в гепатомах свидетельствуют данные W. R. Loewenstein, J. Kanno (1967). При исследовании электрической связи с помощью микроэлектродов они обнаружили, что соседние клетки в нормальной печени имеют высокопроницаемые для ионов контакты. Е. А. Модянова (1970) отметила, что в медленнорастущих гепатомах сила сцепления существенно не отличается от показателей нормальной печени. Эти данные могут служить доказательством сохранения механической и диффузионной связи между клетками медленнорастущей гепатомы.
Для понимания механизмов и роли контактных взаимоотношений в процессах бластомогенеза имеет значение электронномикроскопическое исследование структур МК. При изучении быстрорастущего штамма гепатомы мышей 22-а Ю. С. Ченцов, Л. В. Ольшевская (1966) обнаружили нарушения структуры МК в области зоны замыкания. Л. В. Ольшевская (1971) подвергла электронномикроскопическому исследованию 5 различных штаммов мышиных гепатом. Наиболее демонстративное расхождение клеточных поверхностей с образованием широких межклеточных щелей с микровыростами вдоль всего клеточного периметра с утратой специализированных структур МК выявлено в быстро-растущих гепатомах 60 и 61. В гепатомах 46 и 48, скорость роста которых ниже, отмечены минимальные изменения структуры МК (нарушена структура контакта в зоне плотного соединения и обнаружено расхождение мембран в зоне простого соединения). Самая большая степень нарушения специализированных структур МК и более значительное расхождение клеточных поверхностей в области простого соединения выявлены в наиболее медленнорастущей гепатоме 49. Представляет интерес наблюдение автора о том, что нексусы сохраняются как в быстрорастущих, так и в медленнорастущих гепатомах. Л. В. Ольшевская (1971) приходит к выводу о том, что скорость роста гепатом не зависит от степени утраты специализированных структур МК и отражает независимую прогрессию признаков злокачественности. Исследуя те же гепатомы (штаммы 46 и 48), В. М. Бреслер и соавторы (1968) не наблюдали существенных изменений в структурах МК. При электронномикроскопическом исследовании МК в спонтанно возникшей аденокарциноме ацинариых клеток поджелудочной железы собаки выявлены фрагментация плотных соединений и уменьшение числа и размеров нексусов. Если на замороженных сколах нормальных ацинарных клеток в области щелевого соединения можно обнаружить 4400 плотноупакованных частиц диаметром 4-5 нм, то у опухолевых клеток нексусы на сколах содержат всего 40-50 частиц. Вместе с тем различий в строении частиц нексуса у опухолевых клеток по сравнению с нормальными не отмечается (J. Alroy и др., 1978). Основная масса исследований свойств МК опухолевых клеток проведена на перевивных штаммах или в тканевой культуре. Работ, посвященных изучению свойств МК на этапах опухолевой трансформации и особенно в раннем латентном периоде, известно немного. Одиночная подкожная инъекция 20-метилхолантрена вызывает у мышей в период 2-6 нед изменения в структуре МК (изменяется эпидермис межклеточного пространства и утрачивается способность к образованию десмосом (R. A. Bhisey, S. М. Sirsat, 1977). В. U. Pauli и соавторы (1978, 1979) с помощью количественной электронной микроскопии обнаружили у водяных крыс в опухоли мочевого пузыря, вызванной с помощью химического канцерогена FANFT, уменьшение числа десмосом на единицу поверхности плазмолемм. При изучении межклеточных взаимодействий эпидермиса методом сканирующей электронной микроскопии у мышей линии NMRI, подвергнутых действию малых доз ДМБА, отмечено освобождение латеральных поверхностей клеток от элементов МК и значительное расширение межклеточных пространств (D. Komitowsky и др., 1977). Представляют интерес исследования, проведенные сотрудницей кафедры патофизиологии Днепропетровского медицинского института Н. С. Роговой (1975). Она изучала динамику ряда характеристик клеточной поверхности, в том числе и МК, гепатоцитов в латентном периоде индуцированного бластомогенеза в опытах на белых крысах (самцах линии Вистар) массой 80-100 г. Животные находились на малобелковой диете, предложенной Миллерами (1948). В качестве гепатоканцерогена использован диметиламиноазобензол-пара (ДАБ), включенный в диету в концентрации 0,06%. На протяжении 10 мес опыта через интервалы в 1 мес крыс группами забивали и исследовали величину сцепленности МК, устойчивость и репарационную способность клеточной поверхности гепатоцитов, а также состояние ультраструктур МК. Величину сцепленности и устойчивости гепатоцитов определяли методом жидкостной дезинтеграции (В. И. Архипенко, Г. А. Чуич, 1968). Репарационная способность клеточной поверхности гепатоцитов исследована по методике, предложенной В. И. Архипенко, В. Ф. Ушаковым, Г. А. Чуичем, Л. В. Гербильским (1974).
Результаты изучения свойств клеточной поверхности и МК в латентном периоде индуцированного ДАБ гепатоканцерогенеза представлены на рис. 58. Установлено, что величина сцепленности гепатоцитов у крыс существенно не изменяется в течение 2 мес латентного периода, на протяжении 3-го месяца она существенно уменьшается и возвращается к показателям контрольной группы к 5-6-му месяцу, увеличивается к 7-8-му месяцу и достоверно понижается к 9-10-му месяцу после начала введения животным канцерогена. Снижение величины сцепленности на поздних этапах индуцированного бластомогенеза, т. е. в период формирования бластом, состоящих из анаплазированных в определенной степени клеток, подтверждает данные вышеуказанных авторов о снижении величины сцепленности между опу-холевыми клетками по сравнению с нормальными.
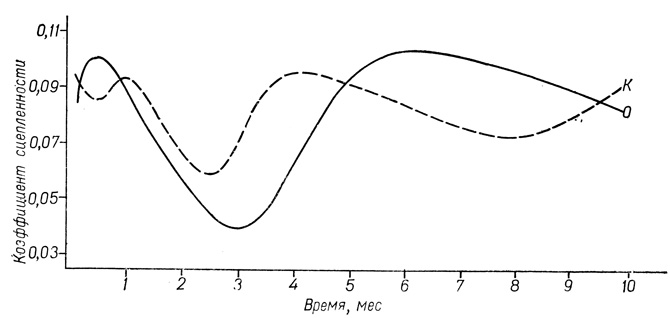
Рис. 58. Динамика величины сцепленности гепатоцитов на этапах латентного периода индуцированного ДАБ гепатобластомогенеза: по оси абсцисс - время, по оси ординат - коэффициент сцепленности
Особенный интерес представляют данные об уменьшении величины сцепленности гепатоцитов в раннем латентном периоде (3-4 мес скармливания ДАБ), т. е. до появления морфологических критериев опухолевой трансформации. По-видимому, они свидетельствуют о том, что молекулярные и субклеточные изменения свойств поверхности гепатоцитов наступают значительно раньше, чем выявляются морфологические критерии опухолевой трансформации. Если считать, что уменьшение величины сцепленности является одним из условий реализации программы метастазирования, то отмеченное автором понижение этого параметра на раннем этапе бластомогенеза позволяет высказать мысль о возможности начала расселения с лимфо- и кровотоком клеток до появления у них морфологических признаков прошедшей опухолевой трансформации. Дальнейшая судьба этих клеток, очевидно, зависит от локализации и влияний, идущих от основного очага опухолевого процесса. Повышение величины сцепленности на 7-8-м месяце эксперимента наблюдается в период появления первых морфологических признаков, указывающих на начало опухолевой трансформации. На начальном этапе гепатобластомогенеза (первые 2 мес), когда в результате введения первых порций ДАБ должно было проявиться токсическое действие препарата на паренхиму печени, величина сцепленности гепатоцитов существенно не изменялась.
Исследование устойчивости гепатоцитов по предложенной нами методике характеризует устойчивость клеточной мембраны к действию механического гидродинамического фактора. Изменение этого показателя может дать дополнительную информацию о механизме нарушения сцепленности. Существует мнение, что устойчивость контактов между клетками зависит не столько от силы адгезии, сколько от прочности мембран (Дж. Тринкаус, 1972). Как было показано В. Ф. Ушаковым (1977), клетки при дезинтеграции могут не только разделяться по поверхности кон-такта, но и отрываться от нее, оставляя на месте контакта часть своей плазмолеммы.
Данные Н. С. Роговой (1977) о динамике коэффициента устойчивости в латентном периоде индуцированного ДАБ гепатобластомогенеза представлены на рис. 59. Коэффициент устойчивости только через 2 и 5 мес после начала скармливания ДАБ существенно отличается от контроля: у подопытных крыс через 2 мес меньше, а через 5 мес больше, чем у контрольных животных.
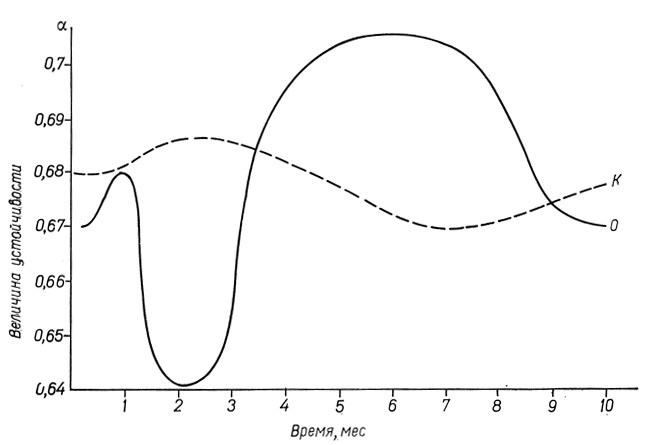
Рис. 59. Динамика коэффициента устойчивости гепатоцитов на этапах латентного периода гепатобластомогенеза, индуцированного ДАБ: по оси абсцисс - время, по оси ординат - коэффициент устойчивости
Между устойчивостью мембран гепатоцитов и величиной сцепленности в эти сроки корреляции не наблюдается.
Клетки обладают способностью заделывать "микропробоины" своей поверхности. Для репарации своей поверхности клетке достаточно сохранить ядро, небольшую часть цитоплазмы и хотя бы маленький участок поверхности. А. Г. Маленков, Е. А. Модянова (1966) обнаружили, что после диспергирования пребывание гепатоцитов в растворе, содержащем Са++, повышает устойчивость их к лизирующему действию трипсина. Авторы считают, что к этому времени "пробоины" в плазмолемме исчезают. Изучение способности клеток к репарации своей поверхности может иметь значение в характеристике свойств поверхности клеток.
Результаты исследования репарационной способности гепатоцитов на этапах индуцированного ДАБ гепатобластомогенеза представлены на рис. 60. Анализ этих данных показывает, что репарационная способность гепатоцитов крыс, вскармливаемых ДАБ, снижена в первые 4 мес опыта, затем она восстанавливается до уровня контроля, с 5-го месяца и на протяжении 3 последующих месяцев повышается и значительно превышает уровень контрольной группы.
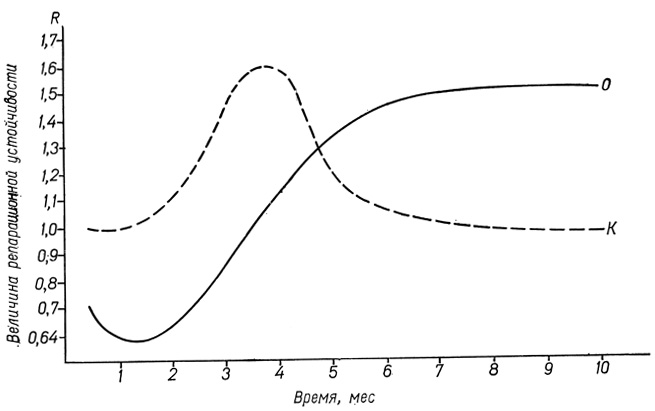
Рис. 60. Динамика величины репарационной способности гепатоцитов на этапах латентного периода гепатобластомогенеза, индуцированного ДАБ: по оси абсцисс - время, по оси ординат - величина репарационной способности
Репарационная способность клеток, в том числе способность "заделывать микропробоины" своей поверхности, по-видимому, определяется совместным действием двух видов факторов: уровнем синтетических процессов, подготавливающих "материалы" для восстановления белково-липидной структуры поверхности, частотой и размерами повреждений, возникающих на поверхности клеток.
Об уровне синтетических процессов клетки можно судить по содержанию в ней рибонуклеопротеидов. Обнаружено уменьшение количества рибонуклеопротеидов в гепатоцитах в первые месяцы опыта, что свидетельствует о перестройке синтетических процессов в клетке, вызванной появлением в окружающей их среде канцерогена.
Восстановление репарационной способности клеток на следующем этапе эксперимента (4-5 мес), по-видимому, объясняется обновлением в значительной степени клеточной популяции гепатоцитов в процессе гепатобластомогенеза (В. И. Гельштейн, 1963).
Можно допустить, что эти клетки имеют иные свойства на уровне синтетических процессов и в устойчивости плазмолемм к действию канцерогена.
Особенный интерес вызывают данные о повышении репарационной способности гепатоцитов на позднем этапе латентного периода гепатобластомогенеза (6-10 мес). Можно предложить следующее объяснение этому феномену. Далеко зашедшая опухолевая трансформация изменяет уровень синтетических процессов в клетках в сторону активации синтеза белково-липидных комплексов мембранных структур поверхности, о чем можно косвенно судить по увеличению содержания рибонуклеопротеидов, отмеченного в гепатоцитах, подвергшихся анаплазии. Опухолевая трансформация сопровождается автономизацией клеток, что приводит к уменьшению частоты и силы действия повреждающих факторов, влияющих на клетку не только непосредственно, но и через систему МК. В пользу этого механизма свидетельствуют представленные выше данные об уменьшении величины сцепленности на поздних сроках индуцированного гепатобластомогенеза, а также уменьшение частоты обнаружения с помощью электронной микроскопии контактных соединений типа нексус между гепатоцитами.
Вопросы химического бластомогенеза и роль изменений свойств клеточной поверхности в этом процессе подробно освещены в монографиях Ю. М. Васильева, А. Г. Маленкова (1968), А. Г. Маленкова (1976).
Общепризнанным в этой проблеме является положение о том, что опухолевые клетки отличаются от нормальных, помимо прочего, измененными свойствами клеточной поверхности и что ряд биологических особенностей строения и поведения опухолевых клеток может быть объяснен как результат нарушения строения и свойств клеточной поверхности, приводящих к появлению межклеточных взаимодействий, не свойственных нормальным. Однако еще не выяснено, являются ли новые свойства клеточной поверхности результатом изменения под непосредственным действием канцерогена или они вторичны и вызваны ранее наступившей перестройкой синтетических процессов в клетке.
Не вызывает сомнений положение о том, что изменения свойств клеточной поверхности приводят к нарушению не только контактных взаимодействий, но и тканевой организации, к перестройке клеток и приспособлению их к новым условиям существования. Все это может обусловить накопление уклонившихся от "средних" вариантов и появлению популяции "вариантных клеток".
В биологическом плане увеличение репарационной способности клеток печени на поздних этапах гепатобластомогенеза может быть определено как проявление адаптации к действию контролирующих факторов, способных элиминировать "уклонившиеся от нормы" клетки.
Методика жидкостной дезинтеграции не позволяет на этапах бластомогенеза дифференцировать опухолево-трансформированные участки печени от "внешне интактных" и раздельно определить величину сцепленности различных участков печени. Однако можно высказать предположение, что уменьшение величины сцепленности на поздних этапах гепатобластомогенеза определяется не только за счет опухолево-трансформированных элементов, но и в результате влияния последних на "внешне неизмененную" паренхиму печени. Об этом свидетельствуют данные С. И. Пушкарь (1978). При росте трансплантированных под кожу опухолей и на некоторых этапах индуцированного гепатобластомогенеза она обнаружила появление нарушений в структуре МК тироцитов, т. е. на территориях, значительно удаленных от очага опухолевого процесса.
Н. С. Рогова на тех же объектах исследовала ультраструктуру клеточной поверхности гепатоцитов. Через 1-2 нед после начала вскармливания животных ДАБ васкулярные и билиарные поверхности гепатоцитов сохранялись на уровне интактной печени. Для некоторых была характерна ориентация митохондрий относительно контактных областей. В областях цитоплазмы, прилежащих к МК, митохондрии образовали скопления и их длинные оси располагались параллельно контактным поверхностям. Эти изменения в структурах митохондрий свидетельствуют о развитии определенных контактно-органоидных взаимодействий, которые отражают, очевидно, возникновение более интенсивной функциональной связи между гепатоцитами.
Через 2 мес после начала введения ДАБ на билиарной поверхности располагались отдельные увеличенные микроворсинки. Наблюдалось расширение субэндотелиальных пространств и появлялись выпячивания (протрузии) плазмолемм в эти пространства. Наряду с этим обнаруживались дефекты плазмолеммы. Межмембранное пространство в области простых соединений типа "замка" было не постоянной ширины. Размер его колебался от 20 до 40 нм. Иногда наблюдались области со значительно расширенными (до 0,5 мкм) простыми соединениями. В этом случае участки расхождения были заполнены микровыростами плазмолемм. В отличие от предыдущего срока (1-2 нед индукции) скопления митохондрий, параллельно ориентированных относительно МК, не обнаруживались.
При исследовании ультраструктур гепатоцитов через 5 мес после начала вскармливания крыс ДАБ на васкулярной поверхности гепатоцитов выявлялись разрывы плазмолемм, сопровождающиеся выходом митохондрий, цистерн эндоплазматического ретикулума, микротелец, гранул гликогена в субэндотелиальное пространство. Васкулярная поверхность была сглажена, резко уменьшено число микроворсинок, часто наблюдалась полная потеря гепатоцитами субсинусоидальных микроворсинок. В просвете желчных капилляров, помимо микроворсинок, располагались обширные протрузии билиарной поверхносоти. Большинство исследованных контактов гепатоцитов имели нормальную структуру. Наряду с этим обнаруживались отдельные контакты с измененной структурой, в которых межмебранное пространство простых соединений и соединений типа "замка" было расширено до 30-40 нм. Появлялись соединительные комплексы с колбовидно-расширенными до 40 нм зонами слипания. Нексусы встречались гораздо реже, чем в предыдущие сроки индукции и в контроле. Протяженность их не превышала 1 мкм. Нексус обеспечивает метаболическую связь между клетками (M. U. L. Bennett, 1973). Следовательно, отмеченные изменения числа и размеров нексусов могут трактоваться как результат уменьшения функциональных связей между гепатоцитами и уровнем интегративности ткани.
В. Г. Пинчук и соавторы (1967) изучали ультраструктуру клеток гепатом, индуцированных 2-ацетиламинофлюореном. Они установили, что плазмолеммы контактирующих опухолевых клеток имеют извитой ход, а пространства между ними неравномерно расширены. Комплексы опухолевых клеток нередко отделяются друг от друга значительными свободными пространствами и поверхность их образует многочисленные микроворсинки и цитоплазматические выросты. Это свидетельствует о наступлении изоляции и ослаблении механической связи между клетками индуцированных гепатом.
Исследования Н. С. Роговой показали, что изменения свойств клеточной поверхности гепатоцитов (величины сцепленности и репарационной способности) у крыс с индуцированным ДАБ гепатобластомогенезом развиваются и могут быть выявлены с помощью биофизических методик раньше, чем появляются морфологически достоверные признаки наступления опухолевой трансформации - образование малигнизированных клеток и бластом.
В опухолях щитовидной железы (аденомы, различные формы рака, включая анапластический) сохраняются специализированные соединения МК между фолликулярными тироцитами, в частности, десмосомы. Присутствие десмосом является одним из диагностических признаков, позволяющих по данным электронномикроскопического исследования дифференцировать анапластический рак щитовидной железы от саркомы, между клетками которой десмосомы отсутствуют (E. R. Fischer и др., 1974; R. G. Cameron, T. A. Seemayer, 1975; J. Wellington, E. Gould, 1975).
По мнению Ю. С. Ченцова (1965), в строении МК опухолевых клеток не наблюдается принципиальных отличий от нормы, хотя такие структуры, как "замки" и десмосомы, среди некоторых эпителиальных опухолей наблюдаются значительно реже, чем в норме.
А. Г. Маленков (1976) изучал величину электрической связи и силы сцепления между клетками гепатом, отличающихся друг от друга по скорости роста и способности к метастазированию и отметил, что по этим характеристикам контактов опухолевая ткань сильно отличается от нормальной. Им предложена общая схема изменений свойств МК на этапах опухолевой трансформации и прогрессии опухолей. Уменьшение механической стабильности является самым ранним и характерным изменением контактов при опухолевой прогрессии. Дальнейшее ослабление контактов приводит к нарушению диффузионной связи клеток с последующим превращением ткани в популяцию клеток. На этом этапе прогрессии возможно появление на периферии клеток гипотетических "антиадгезионных компонентов", что обеспечивает маскировку опухолевых клеток от действия иммунных механизмов организма. Дестабилизацию МК можно объяснить частичной потерей тканью АФ, а также изменением физико-химических свойств плазмолеммы. Появление на поверхности опухолевых клеток на поздних этапах трансформации некоторых углеводных компонентов (например, нейраминовых кислот) может обеспечить изоляцию опухолевых клеток от контактов с соседними клетками и иммунными лимфоцитами.
Представляют интерес данные об изменении свойств МК в органных структурах, далеко удаленных от зон опухолевой трансформации и прогрессии. С. И. Пушкарь (1978) при исследовании структуры и функции тироцитов щитовидной железы крыс с трансплантированными опухолями или обследованных на разных этапах индуцированного ДАБ гепатобластомогенеза обнаружила местами расширение межмембранного пространства в области простого соединения, а также образование митохондриально-десмосомальных комплексов, располагающихся вдоль МК.
Таким образом, в процессах бластомогенеза большая роль принадлежит изменениям свойств МК. Еще не установлено, имеют ли они специфический характер. Обнаруженные изменения в структурах и функциях МК позволяют в определенной степени объяснить такие фундаментальные особенности бластомогенеза, как автономизация клеток, изменение свойств их поверхности, с помощью которых они могут осуществлять инвазию и метастазирование. Знание этих положений обусловливает необходимость поиска средств и методик, позволяющих установить и предотвращать или корригировать нарушение свойств клеточной поверхности при опухолевой трансформации.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'