
Глава 2. Репродукция риккетсий
На основании микроскопического изучения фиксированных препаратов - отпечатков инфицированных желточных оболочек куриных эмбрионов и органов животных было получено представление о двух типах размножения риккетсий: обычный тип - путем деления кокковидных (a) или палочковидных (b) форм с образованием гомогенных популяций соответствующего типа, и мицеллярный тип - путем дробления нитевидных образований (d) на однородные кокковидные риккетсии типа a и b, в свою очередь затем превращающихся в более крупные особи типа c и d.
На существование двух типов деления риккетсий в свое время указала Sikora (1940), которая выделила сокращенный и полный циклы, совпадающие с обычным и мицеллярным путем деления риккетсий по П. Ф. Здродовскому.
Изучение морфологии и морфогенеза риккетсий в статическом состоянии на фиксированных препаратах не позволяет проследить за динамикой размножения возбудителя в разных стадиях развития. В лучшем случае можно наблюдать картину конечных состояний развития возбудителя на определенных этапах воспроизведения риккетсий.
Внедрение в практику риккетсиологических исследований тканевых культур и применение микрофото и микрокиносъемки для выявления динамики развития риккетсий позволили углубить знания о характере их воспроизведения.
Поскольку риккетсии являются облигатными внутриклеточными паразитами, для их развития требуются определенные компоненты и системы клетки хозяина. Эта особенность отличает риккетсии от бактерий, способных к репродукции на авитализированных питательных средах за счет собственных энзимных механизмов. Brezina, Kordova, Rosenberg (1960, 1963) считают, что бинарное деление риккетсий не является единственным способом размножения. Процесс размножения риккетсий, видимо, требует активного участия клетки в синтезе риккетсиозного материала, подобно тому как это происходит у крупных вирусов. На основании изучения ультратонких срезов клеток Детройт-6, зараженных риккетсиями Бернета, Rosenberg и Kordova (1962) полагают, что риккетсии по характеру размножения отличаются от бактерий. Основанием для подобного заключения послужили наблюдения Roberts и Downs (1959), которые впервые изучили поведение риккетсий Бернета при выращивании в культуре клеток L мышиных фибробластов и фибробластов куриных эмбрионов. Авторы отметили, что через 2 часа после заражения культуры клеток титр инфекционности возбудителя резко снижается. Спустя 5 часов возбудитель в клетке не обнаруживался и выявлялся только через 21 час. Kordova и Brezina (1963), наблюдая за динамикой размножения риккетсий Бернета в клетках Детройт-6, амнион, Hep-2, выяснили природу отмеченного Roberts и Downs явления. Заражая культуру клеток суспензией желточных мешков куриных эмбрионов и определяя титрованием на куриных зародышах концентрацию возбудителя в клетках через 2, 6, 12, 24, 36 и 48 часов после заражения, авторы установили, что через 6 часов концентрация возбудителя в клетках снижается в 300 - 1000 раз и только через 12 - 24 часа титр культуры повышается. Несмотря на активное размножение риккетсий Бернета, что подтверждается данными титрования, в ранних стадиях инфекционного процесса микроскопически в клетках риккетсии не были обнаружены. Отчетливое понижение инфекционности риккетсий Бернета через 6 часов после заражения культуры клеток не связано с отмиранием вируса, так как в бесклеточной среде за это время активность снижалась всего лишь в 3 раза, а за 48 часов - в 30 раз, тогда как в клетках за 6 часов титр снижался более чем в 300 - 1000 раз. На этом основании авторы считают, что значительное снижение концентрации риккетсий Бернета в ранних стадиях инфекционного процесса можно объяснить эклипс-фазой в развитии риккетсий.
Наличие эклипс-фазы в развитии риккетсий Риккетса и возбудителя лихорадки цуцугамуси в тканевых культурах фибробластов было отмечено Schaechter, Bozeman и Smadel (1957), которые в течение 72 - 96 часов после заражения не обнаруживали риккетсий в инфицированных клетках.
Rosenberg, Kordova (1960, 1962), а также Kordova и Kvicava (1962), детально изучив динамику размножения риккетсий Бернета в клетках тканевых культур с использованием световой, фазовоконтрастной и электронной микроскопии, отметили следующую картину воспроизведения риккетсий. В первые 2 - 4 часа после заражения в цитоплазме на периферии клеток выявлялось значительное число риккетсий типичной формы и размеров, однако уже через 6 - 8 часов видимых форм возбудителя в клетках обнаружить не удавалось. В то же время были видны гомогенные тела, значительно превосходящие по размерам обычные формы риккетсий. Одновременно в цитоплазме появлялись вакуоли различной формы и размеров. Через 20 - 22 часа цитоплазма некоторых клеток имела сетчатую структуру и содержала плотные негомогенные гранулы или крупные гомогенные тела с небольшими рассеянными вакуолями. Спустя 22 - 30 часов число больших телец уменьшалось. В этой стадии в цитоплазме агрегировались мелкие, четко видимые частицы кокковидной или овоидной формы. При большом накоплении риккетсий клетки разрушались, и возбудитель попадал в окружающую питательную среду.
Наблюдая за циклом развития риккетсий в клетках с помощью электронной микроскопии, Rosenberg и Kordova в течение первых 48 часов после заражения не обнаруживали типичных форм риккетсий. Через 48 часов были видны очень крупные (несколько микрон), четко ограниченные, не имеющие наружной мембраны образования (матрицы), представляющие скопление мелкогранулированных гомогенных частиц или компактных, непроницаемых для электронов масс вещества. Через 4 - 6 дней после заражения появлялись образования меньших размеров (около 2 мк), не имеющие наружной мембраны и сходные с вироплазмой. В более поздние сроки скопления гомогенных частиц приобретали наружную оболочку, а внутри этих образований появлялись дисперсные гранулы, из которых образовывались промежуточные формы (0,3 - 1,2 мк) с ясно обозначенной наружной мембраной, тонкогранулированной вироплазмой и плотным центром (нуклеоидом). В итоге из промежуточных форм образовывались относительно мелкие частицы размером 0,3 - 0,6 мк, структура, форма и размеры которых полностью соответствовали элементарным тельцам риккетсий Бернета.
Проведенные исследования позволяют предполагать, что ядро клетки принимает активное участие в процессе репродукции риккетсий. Об этом свидетельствуют изменения ядерного хроматина, скопления которого четко видны по краям ядра и достаточно часто в стороне, прилежащей к месту развития риккетсий.
Наблюдая за развитием возбудителя в динамике, авторы не обнаружили структур, позволяющих допустить наличие у риккетсий бинарного деления. Указанные исследования позволили предположить, что риккетсии Бернета размножаются не простым бинарным делением, а более сложным способом. Существование в некоторых случаях двойных компактных структур, окруженных общей мембраной и имеющих тонкую перегородку, авторы объясняют сегментацией переходных, незрелых форм риккетсиозного материала.
Появление типичных форм риккетсий после предварительных изменений в цитоплазме клетки хозяина, наличие крупных образований с прогрессивно усложняющимся строением позволяют допустить наличие у риккетсий характерного для крупных вирусов типа размножения. Крупные зернистые, гранулированные матрицы при этом могут служить основным материалом, из которого путем дальнейшей дифференциации формируются обычные формы риккетсий.
Следовательно, репродукция риккетсий может быть представлена как дифференциация матриц, синтезированных на базе внедрившихся риккетсий при активном участии в репродукции возбудителя цитоплазмы и ядра клетки.
Schaechter, Bozeman и Smadel, регистрируя с помощью микрокиносъемки цикл развития риккетсий Риккетса в культуре фибробластов крысы 14pf, наблюдали поперечное деление палочковидных форм риккетсий. При этом было видно удлинение риккетсий бациллярной формы, перешнурование, образование двух кокковидных особей, соединенных перемычкой, и расхождение риккетсий. Весь процесс деления занимал 195 минут.
Полученные данные фактически не противоречат ранее сделанному заключению других исследователей, так как наблюдаемое бинарное деление палочковидных особей вполне могло соответствовать сегментации переходных форм риккетсий по Rosenberg и Kordova.
И. Н. Кокорин с соавторами (1963), изучая размножение риккетсий Провачека и Музера и возбудителя клещевого сыпного тифа в культуре клеток Hep-2, наблюдали появление в клетках риккетсий Провачека со 2-го дня, а возбудителя клещевого риккетсиоза - с 3 - 5-го дня после заражения. В первые дни отмечалось появление коротких палочек, а в более поздние сроки - всех морфологических форм, в том числе и нитевидных. В связи с частичным разрушением и вторичным инфицированием клеток для этого периода характерен полиморфизм риккетсий в разных клетках. Спустя 9 - 10 суток после инфицирования клеток наступают лизис риккетсий и исчезновение морфологически определяемых форм возбудителя.
При изучении динамики размножения риккетсий Провачека и Бернета в культуре клеток L и HeLa и выявлении возбудителя люминесцентной микроскопией в клетках, выращенных на слюдинках в пробирках и окрашенных акридиновым оранжевым в разведении 1:30 000, нами было установлено, что в первые 2 - 3 часа риккетсии адсорбированы на поверхности клеток или свободно расположены в питательной среде. В последующие 48 - 72 часа риккетсии в цитоплазме клеток не обнаруживаются и только после 48 - 72 часов удается выявить отдельные пораженные клетки (рис. 8). Максимальное инфицирование клеток происходит на 5 - 7-е сутки, когда поражается до 90% клеток при заполнении цитоплазмы на 50 - 75%. При размножении риккетсий Провачека в клетках L преобладают главным образом a- и b- формы возбудителя (коккобациллярные и короткие палочки), тогда как при размножении риккетсий в клетках HeLa характерно образование длинных цепочек и нитей, включающих десятки риккетсий. Это, возможно, свидетельствует о различной элективности клеток для развития возбудителя. В опытах, выполненных совместно с В. Н. Милютиным, при замедленной микрокиносъемке процесс развития риккетсий Провачека в культуре клеток HeLa и L на питательной среде № 199 с 20% бычьей сыворотки, прослежена динамика репродукции возбудителя. При выращивании риккетсий Провачека в культуре клеток HeLa (рис. 9) в цитоплазме инфицированных клеток обнаружены бациллярные, палочковидные и нитевидные формы риккетсий Провачека, количество которых в процессе наблюдения непрерывно увеличивалось. Однако ни в одном из опытов не удалось с достоверностью наблюдать деление риккетсий, несмотря на то что во многих случаях была четко видна дискретность нитевидных форм возбудителя. На рис. 10 представлена динамика развития риккетсий Провачека в культуре клеток L. И в этом случае отчетливо прослеживается нарастание массы риккетсий с преимущественным преобладанием коккобациллярных форм. Вследствие большой плотности скопления риккетсиозных частиц не удается дифференцировать другие морфологические формы возбудителя. Характерно, что в отличие от диффузного расположения риккетсий в цитоплазме клеток HeLa в клетках L конгломераты элементарных частиц риккетсий сконцентрированы вокруг ядра, и разрастание колоний происходит от ядра к периферии пораженной клетки. Развитие риккетсий Провачека в культурах клеток в течение длительного времени (5 - 7 суток) не вызывает заметных деструктивных изменений в пораженной клетке.
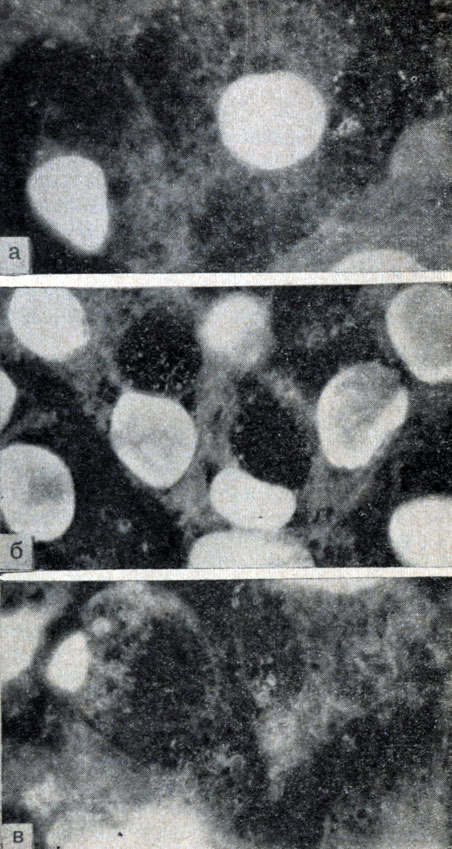
Рис. 8. Микрофото. Динамика размножения риккетсий Бернета в клетках L. Люминесцентная микроскопия. Увеличено в 900 раз. а - адсорбция и внедрение риккетсий в клетки; б - образование вакуолей; в - вакуоль оттеснила ядро на периферию клетки, нарушена целостность клеточной оболочки, риккетсии находятся в межклеточной среде. Оригинал
В отличие от роста риккетсий Бернета при развитии риккетсий Провачека не образуются характерные вакуоли с включенными в них колониями элементарных частиц. Однако в дальнейшем, несмотря на отсутствие грубых морфологических повреждений, связанных с нарастанием массы риккетсиозных частиц, в ряде случаев заполняющих практически всю цитоплазму клеток, инфицированные клетки утрачивают полигональную форму, округляются (рис. 9, ж и з) ив конечном итоге разрушаются (рис. 9, и, 10, г), в результате чего в питательную среду поступает большое количество возбудителя, способного инфицировать новые клетки.
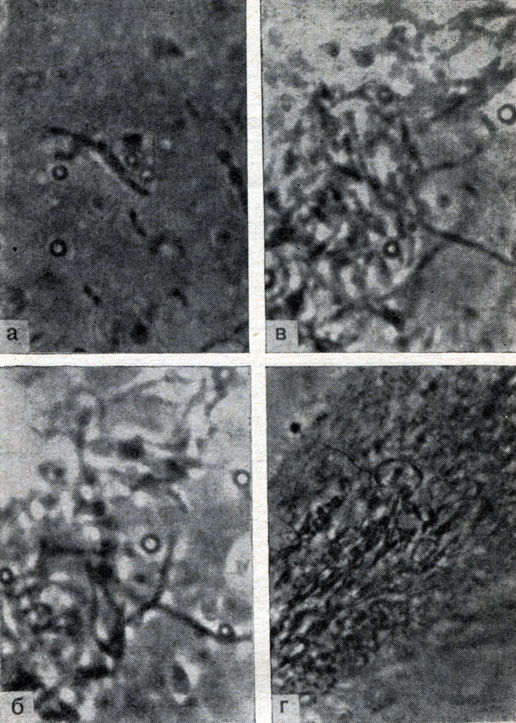
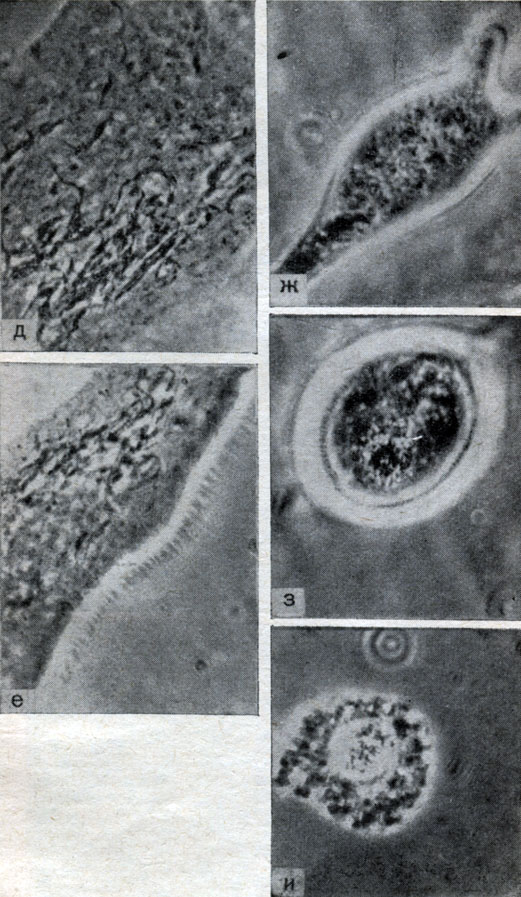
Рис. 9. Микрокиносъемка. Динамика развития риккетсий Провачека в клетках HeLa. Фазовоконтрастная микроскопия. Увеличение от а до в в 1800 раз, от а до и в 900 раз. Интервалы между съемкой 4 - 10 часов. Оригинал
Сравнивая представленную выше картину репродукции риккетсий Бернета и риккетсий Провачека с характером размножения таких крупных вирусов, как вирусы оспы, осповакцины, пситтакоза - орнитоза, а также вируса гриппа (О. В. Конош и И. А. Граф, 1963; В. Я. Подолян и соавторы, 1964; В. М. Жданов, 1964; А. Ф. Быковский, 1964), можно установить наличие ряда общих закономерностей в их развитии, резко отличающих вирусы и риккетсии от бактерий. Так, схема репродукции вируса орнитоза во многом совпадает с фазами развития риккетсий в культуре клеток. Данное обстоятельство позволяет сделать заключение о сходном механизме репродукции риккетсий и крупных вирусов, имеющих много общих биологических особенностей, объединяющих их и позволяющих выделить в промежуточную группу между истинными вирусами и бактериями.
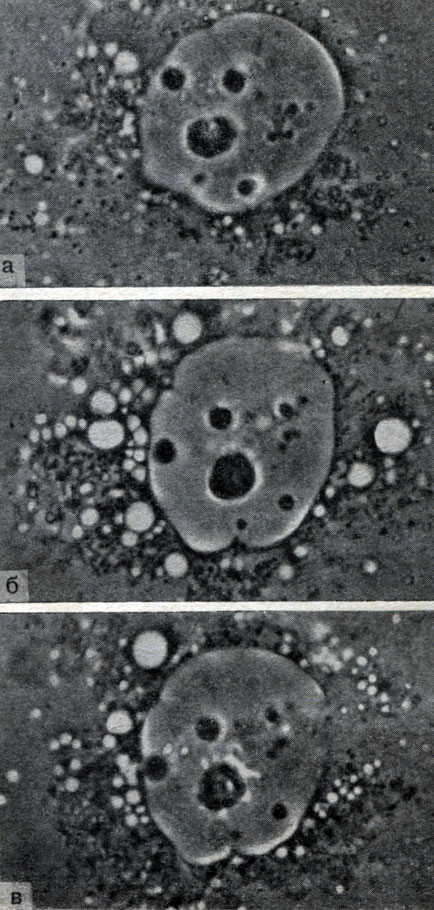
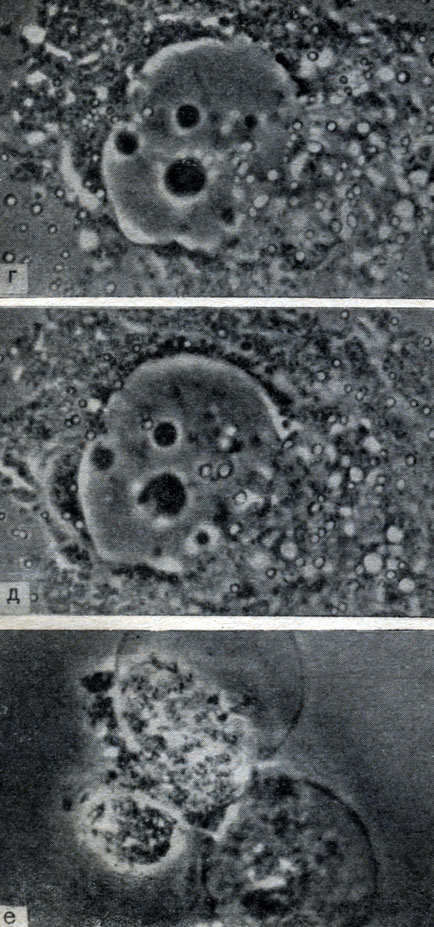
Рис. 10. Микрокиносъемка. Динамика развития растная микроскопия. Увеличено в 1800 раз. Инриккетсий Провачека в клетках L. Фазовоконт - тервалы между съемкой 10 - 12 часов. Оригинал
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'