
Глава 3. Фильтрующиеся формы риккетсии
Риккетсии Бернета и Провачека и, возможно, риккетсии Риккетса обладают своеобразной особенностью, выражающейся в наличии форм, невидимых при обычной световой микроскопии и проходящих через фильтры.
Одной из характерных особенностей риккетсий Бернета является их способность к образованию фильтрующихся форм, что было установлено Burnet и Freeman (1937), Сох (1938), Davis и Сох (1938), а позже подтверждено другими авторами. Plotz с соавторами (1943) видели субмикроскопические частицы при электронной микроскопии фильтратов риккетсий Бернета, однако не смогли объяснить наблюдаемого феномена.
Способность риккетсий Бернета проходить через бактериальные фильтры нашла свое отражение в первоначальном названии возбудителя - R. diaporica (фильтрующиеся). Установлено, что фильтрующиеся формы риккетсий Бернета легко проходят через фильтры Беркефельда V, N и W (Cox, 1938, 1940; Davis, 1939; Herzberg, 1947), Мандлера 7 - 9 (Robbins с соавторами, 1946), Шамберлана L2, L3 (Blanc с соавторами, 1946, 1947; Blanc, 1951) и L5 (Wiesmann, 1948), через мембранные фильтры со средним диаметром пор 700, 500, 400 и 350 ммк (Burnet, Freeman, 1937; Blanc с соавторами, 1946, 1947; И. А. Шифрин, 1953; Bengtson, 1941). Противоречивые данные существуют о возможности прохождения R. burneti через асбестовый фильтр Зейтца. По данным Davis и Cox (1936), Cox (1940), Wiesmann (1948), риккетсии Бернета задерживаются фильтром Зейтца, однако Herzberg (1947), И. А. Шифрин (1953), М. П. Чумаков с соавторами (1954) показали способность этого возбудителя проходить через фильтр Зейтца. Риккетсии Бернета, содержащиеся в культуре из желточных оболочек куриных эмбрионов, проходят через фильтры с диаметром пор 640 и 400 ммк, но задерживаются мембранными фильтрами с диаметром пор 190 ммк (Stoker, 1950). Способность фильтрующихся форм риккетсий Бернета превращаться в обычные формы при пассировании в желточных оболочках куриных эмбрионов была показана В. А. "Пашкевичем (1956), Cox и Bell (1939), Stoker, Smith и Fiset (1956), причем для этого требуется от 3 до 5 пассажей.
В 1933 г. Weiss, использовав методику электронной микроскопии, наряду с обычными бациллярными формами риккетсий Провачека обнаружил около них пылевидные образования размером до десятых долей микрона. Особенно четко эти частицы были видны на препаратах сыпнотифозной вакцины.
В 1945 г. Bengtson показала, что риккетсии Провачека и Музера из желточных оболочек инфицированных куриных эмбрионов проходят через фильтры Беркефельда N и в первом же пассаже переходят в обычные формы возбудителя.
Е. Я. Штернгольд и В. Н. Звагельская (1952) постоянно обнаруживали фильтрующиеся формы риккетсий Провачека в фильтратах суспензии легких интраназально зараженных белых мышей. При последовательных пассажах на мышах фильтрующиеся формы переводились в обычные. При этом была установлена зависимость скорости превращения фильтрующихся форм в обычные от способа фильтрации. Так, в случае использования фильтров Шамберлана L3 микроскопически видимые формы риккетсий удавалось обнаруживать после второго пассажа, при употреблении мембранных фильтров (500 - 700 ммк) - после 3 пассажей, при применении фильтров Зейтца - после 3 - 5 - го пассажа, а при фильтрации через фильтры Шамберлана L5 (более мелкие поры) - только после 5 - 7 пассажей. Последующие исследования показали, что фильтрующиеся формы риккетсий Провачека, как и риккетсий Бернета, не обладают патогенностью и иммуногенностью и только после пассирования в куриных эмбрионах и перехода в видимые формы риккетсии приобретают первоначальные свойства возбудителя (В. А. Крестовникова, 1958).
П. Ф. Здродовский (1948) и В. И. Журбина (1958) отметили наличие фильтрующихся форм риккетсий Провачека в старых, лизированных культурах возбудителя и указали на малую патогенность их для куриных эмбрионов и морских свинок. Авторы полагали, что фильтрующиеся формы являются продуктом спонтанного лизиса риккетсий. Однако только изучение процессов репродукции риккетсий в тканевых культурах при наблюдении за динамикой их развития позволило выяснить механизм образования фильтрующихся форм.
Kordová (1958, 1959, 1960) установила, что через 3 - 6 часов после заражения клеток типичные формы риккетсий исчезали. В это время появлялись пылевидные частицы или зернышки, выявлявшиеся только при электронной микроскопии. Эти формы на 5 - 7-й день вновь превращались в более крупные образования, видимые не только в электронном микроскопе, но и при обычной световой микроскопии. Детальное изучение пылевидных частиц с применением обычной и электронной микроскопии позволило проследить фазы превращения фильтрующихся форм. При заражении куриных эмбрионов ультрафильтратами (размер пор 84 ммк) Kordova (1959) ни в одном случае не выявила риккетсий Бернета. В цитоплазме некоторых клеток при микроскопии мазков из желточных оболочек обнаруживались мелкие и более крупные шары. В некоторых случаях внутри этих включений выявлялись скопления очень мелких, пылевидных частиц. В протоплазме других клеток были обнаружены диффузно распространенные или же соединенные в глыбки пылевидные частицы. Лучше всего они выявлялись в вакуолизированных клетках. Во втором пассаже в куриных эмбрионах количество таких клеток увеличивалось. Пылевидные частицы были видны более отчетливо, иногда появлялись одиночные гранулки и скопления зернышек и частицы, напоминающие кокковидные формы риккетсий Бернета, но меньшего размера. После 3 - го пассажа были видны кокковидные мелкие риккетсии Бернета и очень редко - нитевидные формы, состоявшие из 6 - 8 и большего количества кокковидных частиц. В культурах 4 - 5-го пассажей регулярно выявлялись риккетсии Бернета характерной формы, размеров и окраски. Описанные явления наблюдались при заражении куриных эмбрионов фильтратами, полученными после пропускания суспензии через мембраны с величиной пор 100, 79 и 65 ммк. Это дает основание считать, что размеры фильтрующихся форм риккетсий Бернета равны примерно 30 ммк, тогда как обычные формы имеют размеры не менее 300 ммк. При титровании фильтрата на куриных эмбрионах установлено, что фильтрующиеся формы риккетсий содержатся в нем в очень высокой концентрации, достигающей 1010 ED50. В то же время показано, что при заражении морских свинок неразведенным фильтратом клиника заболевания соответствует симптомам, наблюдающимся при введении культуры обычных форм возбудителя в разведении 10-4. Таким образом, 1 ED50 обычных риккетсий Бернета соответствует примерно 104 ED50 фильтрующихся форм риккетсий.
Иная картина наблюдалась при заражении фильтратом риккетсий культуры тканей. Через 8 дней после инфицирования тканевой культуры в цитоплазме вакуолизированных клеток выявлялись включения и скопления пылевидных частиц. После 14 - 18 дней в клетках зараженной фильтратом ткани появлялись риккетсии Бернета различной величины и формы.
Kordová и Rehácek (1959), обследуя клещей I. ricinus, D. marginatus, Haemaphysalis inermis, зараженных внутриполостным введением фильтратов риккетсий Бернета, через 2 - 3 дня находили в клетках кишечника, яичников, жировой ткани и в гиподерме гомогенные, резко очерченные, интенсивно окрашивающиеся образования разной величины. На 4 - 6-й день число телец - включений увеличивалось, а их субстанция, казавшаяся ранее гомогенной, состояла как бы из множества пылинок или отдельных более крупных гранул. При обследовании на 7 - 8-й день выявлялись конгломераты коккоподобных, интенсивно окрашенных частиц. К 15-му дню в разных тканях четко были видны типичные формы риккетсий Бернета. В отдельных клетках гемолимфы уже через 2 дня после заражения фильтратом риккетсий Бернета появлялись своеобразные включения, количество и размер которых на 4 - 5-й день значительно возрастали. Спустя 6 - 7 дней в цитоплазме выявлялись скопления кокковидных частиц, а после 10 дней в большинстве клеток были видны различной формы типичные риккетсии Бернета.
Эти же авторы (1964) наблюдали аналогичную картину развития фильтрующихся форм риккетсий Провачека в клетках разных органов клещей (I. ricinus, D. marginatus и H. asiaticum). В течение первых 3 суток после заражения типичные морфологические образования риккетсий выявить не удавалось. Между 3-м и 6-м днем наблюдалась вакуолизация цитоплазмы клеток; внутри крупных вакуолей появлялись мелкие пылевидные частицы, иногда заполняющие всю цитоплазму. В более поздние сроки (5 - 9-й день) в вакуолях обнаруживались четко окрашивающиеся кокковидные образования, а к 14-му дню выявлялось интенсивное размножение обычных форм риккетсий Провачека.
Резюмируя результаты этих исследований, можно сделать заключение, что при развитии фильтрующихся форм риккетсий в клещах процесс их превращения в обычные формы занимает 8 - 10 дней. В культуре тканей этот процесс требует большего времени и продолжается 12 - 14 дней, тогда как трансформация фильтрующихся форм в обычные в желточных оболочках куриных эмбрионов требует проведения 3 - 4 пассажей, т. е. продолжается не менее 30 - 40 дней. В случае заражения всех перечисленных моделей обычными формами риккетсий Бернета цикл развития длится около 8 - 10 дней.
Эти опыты, по-видимому, позволяют расшифровать причину медленного (в течение 2 - 3 пассажей) превращения фильтрующихся форм в обычные в куриных эмбрионах. Если, согласившись с предпосылками авторов, исходить из того, что фильтрующиеся формы риккетсий - это генетический аппарат возбудителя в незрелом состоянии, т. е. по существу нуклеиновые кислоты, в значительной мере лишенные белковой оболочки, то можно предположить, что одного пассажа в куриных эмбрионах недостаточно для прохождения незрелым вирусным материалом полного цикла развития (развертывание, репликация и конденсация генетического материала). Попавший в клетку генетический материал (фильтрующиеся формы риккетсий), лишенный белковой оболочки, вероятно, адаптируется к новой клеточной системе, восстанавливает утраченную белковую субстанцию, необходимую для воспроизведения зрелых форм возбудителя. Различная скорость репродукции фильтрующихся и обычных форм риккетсий может свидетельствовать о роли белкового компонента для воспроизведения зрелых, "споровых" форм риккетсий, так как он содержит, по-видимому, неотъемлемую часть генетического или промежуточного информационного материала (РНК, рибосомы, специфические белки - ферменты и т. д.).
На отсутствие белковых компонентов в составе фильтрующихся форм риккетсий указывают наблюдения Kordová (1959, 1960), Kordová и Rehácek (1959), которые установили, что антигены из желточных мешков после первых 2 пассажей фильтрата не реагируют в РСК с иммунными сыворотками морских свинок. Антигены из культуры 4-го и 5-го пассажей в куриных эмбрионах оказались активными в РСК - Иммунизация морских свинок фильтратами из желточных мешков не приводит к образованию у них комплементсвязывающих антител. Лишь в единичных случаях антитела обнаружены в титре 1:8 при введении материала 1 - 2-го пассажа фильтрата в куриных эмбрионах. Максимальные титры отмечены при введении животным культуры 5-го пассажа фильтрата, в котором были обнаружены многочисленные видимые формы риккетсий Бернета.
Таким образом, несмотря на наличие в фильтрате высокой концентрации фильтрующихся форм возбудителя (около 1010 ED50 ДЛЯ куриных эмбрионов), антигенный и иммуногенный эффект подобных культур весьма низок. Образование антител как у иммунизированных, так и у инфицированных животных определяется антигенными компонентами, которые присутствуют в морфологически зрелых частицах риккетсий.
Эти наблюдения полностью согласуются с данными Ormsbee (1952), который отметил, что антиген риккетсий Бернета в желточных оболочках куриных эмбрионов накапливается, начиная с 4-го дня, и высказал мнение, что антигенный материал формируется из корпускулярных элементов риккетсий, а растворимый антиген представляет расщепленные оболочки риккетсий. Аналогичные выводы сделаны и другими исследователями, которые показали, что риккетсиозные антигены заключены в оболочке возбудителя и состоят не менее чем из 2 белковых фракций (Shepard, Wyckoff, 1946; Н. Н. Ураков, 1961; Л. И. Райхер и соавторы, 1963).
Антигенная и иммуногенная неполноценность фильтрующихся форм риккетсий свидетельствует о том, что они не "осколки" распавшихся корпускул риккетсий, а особая форма существования возбудителя в процессе развития. Доказательством этого служит сохранение иммуногенных и антигенных свойств у химически или механически расщепленных риккетсий (растворимый антиген, химическая вакцина). Эти данные не согласуются с представлением о регенеративном характере превращения фильтрующихся форм риккетсий, которые, вероятно, по своей природе отличаются от фильтрующихся форм бактерий, сохраняющих основные свойства обычных микроорганизмов. Способы получения фильтрующихся форм бактерий близки к методам приготовления растворимых риккетсиозных антигенов (воздействие ультразвуком, химическими реагентами) (Г. П. Калина, 1962).
Возможность существования в клещах невидимых форм риккетсий Риккетса предполагали Spencer и Parker (1930). В опытах Price (1954) установлено, что авирулентная фаза риккетсий Риккетса в длительно хранившихся при низкой температуре голодных клещах не выявляется даже после 3 пассажей на морских свинках, но обнаруживается после однократного кормления клещей на здоровых животных. На этом основании автор сделал вывод, что авирулентная фаза у риккетсий Риккетса может быть в некоторой степени отнесена к "неполной" форме возбудителя. Иными словами, в процессе репродукции риккетсий Риккетса в клещах выявлена эклипс-фаза, характерная для развития других видов риккетсий (риккетсий Бернета и Провачека).
Суммируя данные по морфогенезу и репродукции риккетсий, можно сделать предположение, что риккетсии в своем онтогенезе, по-видимому, проходят те же циклы (фазы) развития, что и крупные вирусы типа хламидозоа, наиболее близкие к риккетсиям.
На основании накопленных данных о природе риккетсий можно следующим образом представить характер репродукции риккетсий (рис. 11). "Споровые" формы риккетсий, находящиеся в стадии относительного биогенетического покоя и представляющие различные типы микроскопически выявляемых риккетсий, попадая в оптимальную среду обитания и проникая в цитоплазму чувствительных к вирусу клеток, проходят ряд последовательных этапов развития, морфологически определяемых различным состоянием вирусного материала. После непродолжительного пребывания в цитоплазме клетки (30 - 60 минут) в неизмененном виде (1) риккетсии постепенно утрачивают оболочку и образуют скопления мелкозернистого фибриллярно - гранулярного материала (скопления макромолекул веществ, содержащих нуклеиновые кислоты) (2). Снижение инфекционности культур и отсутствие визуально выявляемого при световой микроскопии возбудителя свидетельствуют о том, что этот этап развития риккетсий соответствует неинфекционной фазе существования вирусов, или эклипс-фазе. Наступающую при этом дезагрегацию корпускул и последующее увеличение размера гранул, по-видимому, следует отнести к процессу развертывания и нарастания массы генетического материала (3). По аналогии с крупными вирусами эту фазу развития возбудителя следует отнести к "вегетативной" стадии, т. е. к состоянию активного воспроизведения риккетсий, в отличие от "споровой" стадии относительной стабильности и покоя возбудителя. На этом этапе образования матриц, возникающих в результате значительного увеличения массы гранулированной субстанции и уплотнения генетического материала, иногда нарушается целостность клеточной оболочки и часть образовавшихся скоплений зернистой субстанции (матриц) выходит в межклеточное пространство (3а). Появлением вне клеток незрелого риккетсиозного материала (нуклеопротеидов), вероятно, и объясняется образование фильтрующихся форм возбудителя.
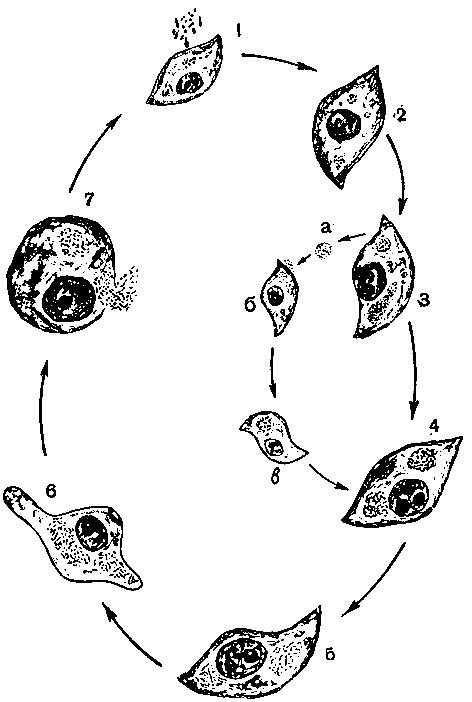
Рис. 11. Схема репродукции риккетсий. 1 - внедрение в клетку 'вироспор' ('споровая' форма риккетсий, стадия относительного покоя), 1 - 60 минут; 2 - дезагрегация структурных единиц возбудителя (развертывание генетического аппарата риккетсий) - эклипс - фаза, 1 - 24 часа; 3 - стадия образования матриц (нарастание массы фибриллярногранулярного вещества) - эклипс - фаза, 24 - 36 часов; 4 - свертывание генетического аппарата риккетсий - уплотнение гранул с образованием мелкозернистой субстанции, 36 - 48 часов; 5 - образование промежуточных форм риккетсий и их сегментация с дифференциацией типичных форм, 3 - 4-е сутки; 6 - образование зрелых форм риккетсий ('вироспоры'), 4 - 6-е сутки; 7 - дегенерация клеток и выхождение риккетсий ('вироспор') в среду, 7 - 8-е сутки: а - выхождение незрелого риккетсиозного материала из клетки в среду; б - внедрение отдельных частиц незрелого риккетсиозного материала (фильтрующихся форм возбудителя) в новые клетки; в - нарастание массы фибриллярно - гранулярного вещества - образование матриц
Далее следуют две параллельные линии развития риккетсий. Первая - это продолжение типичного способа воспроизведения возбудителя путем нарастания массы гранулированной субстанции с последующим ее уплотнением (4), что соответствует 36 - 48 часам развития риккетсий. Наступающее свертывание генетического материала с образованием зрелых, капсулированных форм риккетсий определяется появлением визуально выявляемых мелких кокковидных форм возбудителя (5).
Параллельно с этим идет развитие фильтрующихся форм возбудителя. Выброшенные из клетки матрицы распадаются на отдельные гранулы (нуклеопротеиды) (3б), которые внедряются в новые клетки и дают начало образованию новых матриц, претерпевающих далее полный цикл развития, характерный для риккетсий. Однако в случае внедрения в клетку незрелых компонентов риккетсий (гранул фильтрующихся форм, лишенных белковой оболочки), время дифференциации и созревания генетического материала увеличивается, так как требуется определенное дополнительное время на восстановление (синтез) утраченных белковых компонентов, которые сохраняются при воспроизведении риккетсий, происходящем в одной и той же клетке. Характерно, что при репродукции вируса гриппа О. В. Конош и И. А. Граф (1963) наблюдали скопления фибриллярно-гранулярных масс, близких по размерам (150 А) к фильтрующимся формам риккетсий (менее 300 Å).
К 3 - 4-му дню развития возбудителя в клетках появляются видимые при обычной люминесцентной или фазовоконтрастной микроскопии риккетсиозные частицы различной величины, но с преимущественным преобладанием мелких (0,3×0,6 мк) кокковидных, обычно окрашиваемых корпускул (6). На этом же этапе развития видны промежуточные формы (0,3×1,2 мк) с ясно выраженной наружной мембраной и тонкогранулированной вироплазмой. Из промежуточных форм путем образования внутренних перегородок и деления образуются относительно мелкие частицы, соответствующие кокковидным формам (0,3×0,6 мк). Их структура, форма и размеры соответствуют элементарным частицам риккетсий. В этой стадии завершаются цикл развития риккетсий и образование "споровых" форм возбудителя, видимых при микроскопии после окрашивания обычным для риккетсий способом. Они проявляют все присущие этому виду возбудителя биологические свойства.
Что же касается кажущегося противоречия между наличием бинарного способа деления и репродукцией возбудителя при полном генетическом развертывании риккетсиозной частицы с образованием невидимых при обычной микроскопии фибриллярно-гранулярных образований типа нуклеопротеидов и последующим дифференцированием из них видимых, риккетсиозных частиц, то оно находит свое разрешение в том, что бинарное деление является конечным этапом репродукции возбудителя, когда наступает деление промежуточных форм, возникающих при конденсации гранулярных субстанций. В результате изучения процессов внутриклеточного развития риккетсий Бернета и Провачека с применением современных методов электронной микроскопии ультра - тонких срезов нормальных и зараженных клеток и регистрации динамики развития риккетсий в клетках с помощью микрокиносъемки О. С. Гудима (1966) получил принципиально новые материалы по морфогенезу риккетсий, отличающиеся от приведенных выше.
Автор показал, что в момент соприкосновения риккетсий и клеток четко выявляется адсорбция особей возбудителя на поверхности клетки-хозяина с последующим фагоцитированием риккетсий клетками. Морфологически при этом происходит втягивание участка оболочки внутрь цитоплазмы. Инвагинирующий участок клеточной мембраны затем отшнуровывается с образованием вакуоли, внутри которой размножаются риккетсии Бернета, или очень быстро растворяется при инвазии риккетсий Провачека. Начальный процесс внутриклеточного развития риккетсий характеризуется увеличением размеров особей возбудителя, истончением оболочки, рассредоточением элементов нуклеоида, активизацией зоны риккетсиоплазмы, относительным преобладанием рибонуклеиновой кислоты. Одновременно с переходом риккетсий Бернета в активное состояние увеличиваются размеры фагоцитарных вакуолей, внутри которых происходит размножение возбудителя. Рост и размножение риккетсий Провачека происходят непосредственно в веществе цитоплазмы, среди ее органоидов. В процессе внутриклеточного размножения риккетсий бинарным делением количество особей возбудителя увеличивается, формируются риккетсиозные колонии.
В период активного роста и размножения, названный автором вегетативной стадией, риккетсии обладают характерной субмикроскопической организацией. Вегетативные формы риккетсий Бернета имеют трехслойную оболочку, к которой изнутри прилежит слой гранулярной риккетсиоплазмы, ограниченной осмиофильной плазматической мембраной. Риккетсиоплазма окружает ядерную вакуоль, внутри которой находятся фибриллярные и тяжистые, древовидно ветвящиеся образования различной электроннооптической плотности. Ядерная вакуоль с составляющими ее элементами не отграничена какой-либо видимой мембраной от вещества вироплазмы. Именно на стадии вегетативных форм происходит размножение риккетсий бинарным делением, что прослежено прижизненно при фазовоконтрастной микроскопии.
В отличие от риккетсий Бернета активно растущие и размножающиеся вегетативные формы риккетсий Провачека имеют пятислойную оболочку, к внутреннему осмиофильному слою которой плотно прилежит плазматическая мембрана, покрывающая слой гранулярной риккетсиоплазмы с заключенной в ней ядерной вакуолью.
На конечных этапах развития риккетсии заполняют практически всю цитоплазму. На этой стадии совершается переход вегетативных форм в покоящиеся. Стадии покоящихся форм соответствует и иная структурная организация возбудителя, характеризующаяся уплотнением всех элементов, утолщением оболочки, свертыванием генетического материала, резким уменьшением содержания РНК и относительным преобладанием ДНК. При электронномикроскопическом изучении покоящихся форм риккетсий Провачека, контрастированных фосфорновольфрамовой кислотой, О. С. Гудима установил, что их оболочка имеет макромолекулярный слой, состоящий из упорядоченно расположенных глобул 60 - 80 Å в диаметре, а также обнаружил наличие жгутикоподобных придатков типа фимбрий бактерий. Поверхность риккетсий Бернета представляется гладкой, лишенной подобных образований.
На основании экспериментальных данных автор делает вывод о том, что в онтогенезе различных видов риккетсий существуют две основные стадии: вегетативная и покоящаяся, которым соответствуют морфологически и функционально четко дифференцируемые формы возбудителей, а внутриклеточный паразитизм в системе риккетсия - клетка осуществляется на уровне организованной клеточной структуры возбудителя, тогда как паразитизм вирусов реализуется на генетическом, молекулярном уровне. В этом принципиальное отличие внутриклеточных паразитов риккетсий от истинных вирусов.
Что же касается наблюдаемой чешскими авторами картины репродукции риккетсий по вирусному типу, то полученные О. С. Гудима данные, по-видимому, позволяют дать наиболее правильное объяснение природы этого явления. Наряду с описанным выше нормальным циклом репродукции риккетсий автор показал наличие гетероморфного цикла развития, наступающего в некоторых не благоприятных для размножения риккетсий условиях (в присутствии антибиотиков, ряда аминокислот и других веществ). В этом случае наступает трансформация риккетсий, о чем подробнее изложено ниже, морфологическая картина развития особей возбудителя при этом весьма напоминает описание цикла репродукции риккетсий, данное Brezina с соавторами.
Таким образом, представленные взгляды о характере репродукции риккетсий отражают различные состояния (нормальные и патологические) роста и размножения риккетсий в зависимости от условий среды обитания.
Снижение и даже утрата инфекционности, своеобразная морфологическая трансформация и нестабильность формы риккетсиозных частиц в стадиях внутриклеточного развития до образования "споровых" форм позволяют отнести риккетсий к возбудителям вирусной природы, однако ряд характерных особенностей, о которых будет далее сообщено, сближает их с бактериями. Таким образом, очевидно, что риккетсии в мире микроорганизмов занимают промежуточное положение между вирусами и бактериями.
Более полное представление о характере репродукции риккетсий и их таксономическом положении может быть получено при комплексном изучении морфогенеза, химической композиции и метаболизма.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'