
Глава 4. Химический состав риккетсий
За последние 15 - 20 лет накопилось много наблюдений, касающихся химической структуры риккетсий и их метаболизма, которые позволяют составить представление о физиологии риккетсий.
Наиболее раннее сообщение о химическом составе риккетсий было опубликовано Cohen и Chargaff (1944), которые изучили химический состав очищенных риккетсий Провачека, выращенных в желточных оболочках куриных эмбрионов. Очищенные, отмытые и высушенные под вакуумом из замороженного состояния риккетсии содержали 12,2% азота (по Дюма) и 0,93% фосфора. Общее содержание липоидов составило 13,3%. Содержание нерастворимой в ацетоне фосфолипидной фракции достигало 3,1%, а ацетонрастворимой липоидной фракции - 9,5% веса риккетсий. Кроме того, авторы получили из риккетсий две антигенные фракции: RF, которая соответствует примерно 45 - 50% массы риккетсий, и RS, составляющую до 15% веса риккетсий. Химический состав антигенных фракций и риккетсий приведен в табл. 1 и 2.

Таблица 1. Химический состав антигенных фракций риккетсий Провачека (по Cohen и Chargaff, 1944)

Таблица 2. Химический состав риккетсий Провачека (по Cohen и Chargaff, 1944)
Примечание. Поскольку содержание углеводов дано только для двух антигенных фракций, составляющих 60 - 65% всей массы риккетсий, расчет произведен с учетом состава этих фракций. Если допустить полное отсутствие углеводов в остальных 35 - 40% массы риккетсий, то углеводы будут составлять не менее 12,5 - 15% всей массы риккетсий.
При обработке риккетсий трипсином и последующем фракционировании с помощью электрофореза авторы установили наличие у риккетсий нуклеиновых кислот, концентрация которых соответствовала 0,01 мг на 1 мл (по фосфору).
В. И. Товарницкий, М. К - Кронтовская и Н. В. Чебуркина (1946) на примере риккетсий Провачека провели сопоставление химического состава риккетсий и некоторых видов бактерий и вирусов. Для оценки химического состава риккетсий была использована очищенная суспензия из легких инфицированных белых мышей. После экстрагирования липоидов, составляющих 46,3% (в том числе фосфатидов 15,8% и нейтрального жира 29,7%), в оставшейся навеске риккетсий содержание белка достигало 34,7%, а содержание нуклеиновых кислот - 12%. Наряду с ДНК установлено наличие РНК - Авторы, впрочем, не были достаточно уверены в правильности своего заключения. Содержание углеводов достигало 4,1% (в пересчете на глюкозу), а неорганических солей - 3% (табл. 3).

Таблица 3. Химический состав бактерий, риккетсий и вирусов (по В. И. Товарницкому с соавторами, 1946)
Сравнение химического состава риккетсий Провачека, приведенного Cohen и В. И. Товарницким, свидетельствует о значительном различии в содержании отдельных компонентов риккетсий. Особенно заметное расхождение имеется в оценке содержания липоидов и углеводов. Так, в соответствии с данными В. И. Товарницкого содержание липоидов и углеводов соответственно равно 46,6 и 4,1%(, что приближает риккетсии к вирусам, а высокое содержание нуклеиновых кислот (до 12%) сближает их с бактериями. Cohen и Chargaff определили, что содержание липоидов и углеводов у риккетсий близко с их содержанием у бактерий. Полученные результаты хотя и не дают достаточно точных и согласованных сведений о химическом составе риккетсий, но свидетельствуют о том, что риккетсии занимают промежуточное положение между бактериями и вирусами.
Расхождение некоторых показателей химического состава риккетсий Провачека в исследованиях Cohen и В. И. Товарницкого, по-видимому, объясняется использованием разных методов оценки, различной степенью очистки и разными способами получения риккетсий для анализа. Так, низкое содержание липоидов у риккетсий в исследованиях Cohen и Chargaff, возможно, объясняется предварительной эфирной обработкой суспензии, тогда как В. И. Товарницкий с соавторами использовали только дифференциальное центрифугирование.
Последующее изучение химического состава риккетсий с применением современных методов исследования позволило более полно определить их химическую структуру. Так, если работами В. И. Товарницкого с соавторами (1946), Cohen и Chargaff (1944) не было достоверно доказано присутствие у риккетсий РНК, то последующими исследованиями Ris и Fo× (1949) наличие РНК было точно установлено. Авторы исследовали риккетсии Провачека, выращенные в желточных оболочках куриных эмбрионов. Очищенные препараты риккетсий фиксировали 20% раствором формалина, обрабатывали РНК-азой и окрашивали метил - гринпиронином. По степени окрашивания препаратов было сделано заключение о том, что риккетсии содержат различное количество РНК, что, возможно, зависит от физиологического состояния возбудителя.
Callot и Vendrely (1948), изучая влияние ДНК - азы и РНК - азы на риккетсии, установили, что после обработки ДНК-азой наступает значительное ослабление интенсивности окрашивания риккетсий по Романовскому, чего не наблюдается после воздействия РНК-азой. Подобное явление авторы объяснили быстрым удалением РНК из риккетсий при их инкубировании или незначительным содержанием РНК в цитоплазме риккетсий.
Нестабильность РНК риккетсий Музера была установлена исследованиями Cohn, Hahn, Ceglowski и Bozeman (1958). Оказалось, что очищенные и суспендированные в изотоническом растворе риккетсии Музера быстро утрачивают некоторые биологические свойства при 0°. Инактивирование возбудителя может усиливаться при переходе дифосфопиридиннуклеотида (ДПН) из риккетсий в среду, однако инкубация частично инактивированных риккетсий с избытком ДПН ведет к восстановлению утраченных биологических свойств. Изучение природы этого феномена позволило установить, что РНК (22,6γ РНК-фосфора на 1 мг азота) и ДНК (6,3γ ДНК - фосфора на 1 мг азота) в риккетсиях содержатся в отношении 3,5:1, т. е. близком к соотношению нуклеиновых кислот у бактерий. Однако подобное соотношение РНК и ДНК с заметным преобладанием РНК наблюдается только у неинактивированных риккетсий и может быть выявлено лишь при применении точных методов исследования, например фракционированием по методу Шмидта и Таинхаузера при анализе фракций на фосфор, пентозы и ДНК. Количественный анализ рибозы и ДНК показал, что РНК составляет около 75% общего объема нуклеиновых кислот, входящих в состав риккетсиозной клетки. У инактивированных риккетсий соотношение РНК: ДНК изменяется в сторону ДНК.
Способность риккетсий Музера и некоторых других видов риккетсий к реактивации, по мнению авторов, связана с восстановлением в присутствии ДПН нестабильной РНК, утраченной при инактивации. Возможность восстановления утраченной нестабильной РНК зависит от степени инактивации. Если хранение риккетсиозной суспензии при 4° в течение 18 часов связано с обратимой инактивацией в присутствии ДПН, то даже при 3 - часовой экспозиции при 36° наступает необратимая инактивация (табл. 4).

Таблица 4. Реактивация токсичности риккетсий Музера после инактивации при 4 и 36° (по Cohn с соавторами, 1958)
Примечание. Кофактор содержал ДПН 0,33 мг/мл, аденозинтрифосфата 0,33 мг/мл, коэнзима А 0,44 мг/мл и глютатиона 3,3 мг/мл.
Аналогичную потерю РНК и физико-химическую лабильность риккетсиозной РНК можно выявить при оценке результатов, полученных Smith и Stoker (1951) при определении содержания и состава нуклеиновых кислот у риккетсий Бернета. Установленное ими соотношение РНК: ДНК=1:3, возможно, отражает нестабильность РНК (табл. 5).

Таблица 5. Нуклеиновые кислоты и фосфор препаратов риккетсий Бернета (в процентах сухого веса) (по Smith и Stoker, 1951)
Наличие у риккетсий двух нуклеиновых кислот приближает их по химическому составу к вирусам группы орнитоза - пситтакоза и ставит в особое положение по отношению к вирусам, имеющим, как правило, одну нуклеиновую кислоту (ДНК или РНК). В свою очередь, поскольку присутствие двух нуклеиновых кислот характерно для таких более сложно организованных микроорганизмов, как бактерии, грибки и простейшие, наличие двух нуклеиновых кислот у риккетсий может оцениваться как показатель единства происхождения бактерий и риккетсий с последующим эволюционным расхождением в зависимости от условий обитания.
О дифференциации функций РНК и ДНК у риккетсий в отличие от их универсальности у вирусов свидетельствует то обстоятельство, что ДНК у риккетсий обнаруживается преимущественно в ядерном веществе (нуклеоидах), а РНК содержится главным образом в цитоплазме (Cohen, 1955). Применение реакции Фельгена, строго специфической для ДНК, позволило выявить у риккетсий образования типа ядерных структур, морфологически совпадающие с хроматиновыми тельцами. Тем самым было показано, что ДНК не рассеяна диффузно в цитоплазме риккетсий, а образует скопления, напоминающие ядерную субстанцию у бактерий.
Подобное структурное распределение РНК и ДНК полностью согласуется с положением нуклеиновых кислот в клетках других живых объектов и со специфическим функциональным назначением ДНК и РНК. Как известно, ДНК, заключенная в нуклеоиде, содержит информационный код, управляющий синтезом белка любой живой клетки. Что же касается рибонуклеиновых кислот, то природа и функция их весьма разнообразны, но в общих чертах определяются передачей информации, полученной от ДНК, рибосомам, где осуществляется синтез белка. При этом информационная РНК, образовавшаяся в клеточном ядре, где матрицей для нее служат определенные участки длинной нити ДНК, на короткий срок связывается с рибосомами и в свою очередь служит матрицей для синтезируемого белка из аминокислот, доставляемых на рибосомы низкомолекулярной транспортной РНК.
Изучение нуклеотидного состава некоторых видов риккетсий и сравнение их с бактериями, вирусами и тканями, в которых проводится их выращивание, позволяют отметить строгую специфичность соотношения пуриновых и пиримидиновых оснований у каждого вида риккетсий. Убедительно прослеживается и отличие от нуклеотидного состава, характерного для вирусов и бактерий. В то же время по количественному отношению четырех оснований (аденина, гуанина, цитозина и тимина) ДНК риккетсий Бернета мало отличается от ДНК тканей куриного эмбриона. Различие состоит лишь в том, что в составе ДНК куриного эмбриона содержится в значительном количестве 5-метилцитозин (около 4,2% от всего цитозина), тогда как в ДНК риккетсий Бернета 5-метилцитозин находится в очень незначительных количествах, а в ДНК других риккетсий совсем отсутствует.
Некоторые особенности химического состава риккетсий были выяснены при изучении антигенной структуры. Уже ранние наблюдения за риккетсиями при обработке эфиром позволили выявить существенные различия между риккетсиями Музера и Провачека, с одной стороны, и риккетсиями Бернета - с другой. Так, даже кратковременное воздействие на риккетсии Провачека эфиром приводит к растворению их оболочки и образованию растворимого видонеспецифического антигена, реагирующего в перекрестной реакции связывания комплемента с антисыворотками к риккетсиям Музера и Провачека, тогда как длительная обработка риккетсий Бернета эфиром не приводит к разрушению оболочки риккетсий и образованию растворимого антигена.
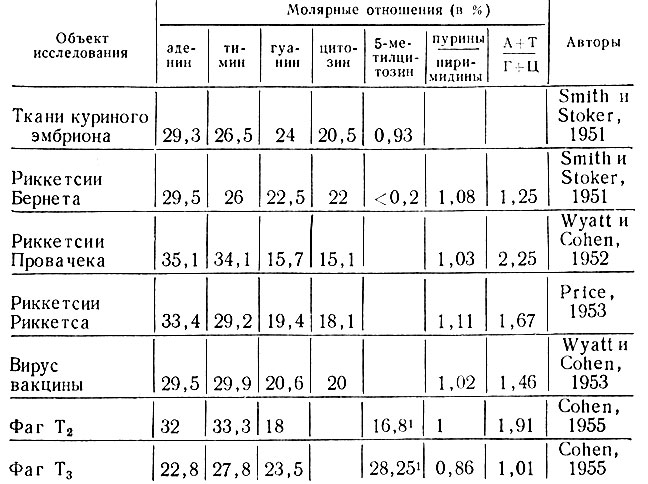
Таблица 6. Сводные данные о нуклеотидном составе некоторых видов риккетсий, вирусов, бактерий и ткани
1 (5 - оксиметилцитозин)
Природа указанного различия определяется неодинаковым химическим составом оболочек этих риккетсий. Так, если оболочка риккетсий группы сыпного тифа содержит преимущественно легкорастворимые в эфире липоиды, то клеточная мембрана риккетсий Бернета I фазы состоит главным образом из полисахаридов (около 95%), нерастворимых в эфире. Липоидная природа мембраны риккетсий сыпнотифозной группы подтверждается окрашиванием их после соответствующей фиксации Суданом III и шарлахротом, т. е. красителями, элективными для жировой ткани (А. В. Румянцев с соавторами, 1947).
Наличие выраженной клеточной мембраны у риккетсий было показано Schaechter с соавторами (1957) на примере риккетсий Музера, а позже было установлено и у других риккетсий. Оказалось, что оболочка риккетсий содержит аминокислоты, глюкозу, гексозамин, глюкуроновую кислоту, галактозу, а также мукопротеиды, составной частью которых является мурамовая кислота, т. е. характерный элемент клеточной мембраны бактерий. Так, Allison и Perkins (1960, 1963) установили наличие мурамовой кислоты, перевариваемой лизоцимом, в составе клеточных оболочек риккетсий Бернета. Спектрографический анализ показал близость содержания мурамовой кислоты в оболочке риккетсий Бернета и золотистого стафилококка. Выявление мурамовой кислоты в составе клеточной мембраны риккетсий и вирусов группы пситтакоза-лимфогранулемы сближает их между собой и указывает на промежуточное положение риккетсий между бактериями, имеющими мурамовую кислоту, и вирусами, которые ее не содержат. Структурное сходство мембраны бактерий и риккетсий находит свое подтверждение также в функциональном единстве действия пенициллина на эти возбудители. Подавление пенициллином синтеза белков клеточной мембраны может объяснять чувствительность к нему риккетсий и вирусов группы пситтакоза-лимфогранулемы и полную индифферентность к его действию других вирусов, лишенных наружной мембраны. Прижизненное наблюдение с помощью микрокиносъемки за механизмом действия пенициллина на развитие риккетсий Бернета позволило установить значительные морфологические изменения риккетсиозных частиц, в том числе и их оболочки (А. Т. Кравченко, В. Н. Милютин, О. С. Гудима, 1961, 1963).
По данным Chambers с соавторами (1950), после эфирной обработки и осаждения риккетсий Провачека центрифугированием в надосадочной жидкости содержалось до 82% комплементсвязывающего растворимого антигена, не обладающего видовой специфичностью. Осадок содержал около 13,7% общей антигенной активности и представлял видоспецифический антиген риккетсий Провачека. Таким образом, установлено, что у риккетсий Провачека поверхностно расположен видонеспецифический антиген липоидо-полисахаридно-протеиновой природы, а под ним - видоспецифический, нерастворимый эфиром белково-полисахаридный комплекс.
Осадок наиболее крупных частиц, полученный после разрушения риккетсиозных корпускул озвучиванием, по своей антигенной активности на 1 единицу азота полностью соответствовал целым риккетсиям, что свидетельствует либо об осаждении неразрушенных риккетсий, либо о незначительном их разрушении. Минимальное количество антигеноактивной субстанции содержится в надосадочной жидкости после тщательного осаждения разрушенных корпускул. На 40 единиц азота приходится 1 единица связывания, т. е. в 8 раз меньше, чем для неразрушенных риккетсий. Содержащийся в надосадочной жидкости растворимый антиген не обладает видовой специфичностью, тогда как полученный после центрифугирования осадок позволяет дифференцировать риккетсии Провачека и риккетсии Музера, ибо ему присуща видовая специфичность. Более того, осадок на 1 единицу азота содержит в 10 раз больше комплементсвязывающих единиц антигена, чем целые риккетсии, и в 80 раз больше, чем надосадочная жидкость. При этом осадок обладает выраженной видовой специфичностью, так как на 1 единицу видоспецифического антигена риккетсий Провачека приходится в 26 раз меньше азота, чем на 1 единицу антигена риккетсий Музера. Расщепление трипсином риккетсиозных частиц повышает выход видоспецифического антигена, что свидетельствует о его белковой природе и отличии от эфирорастворимой липоидной оболочки - носителя видонеспецифической антигенности.
Изучение химического состава отдельных антигенных фракций риккетсий Провачека, разрушенных ультразвуком, позволило показать заметное колебание в них соотношения некоторых компонентов. Так, содержание азота варьировало от 10,34 до 12,79%, фосфора - от 0,7 до 1,05%, углеводов - от 8,56 до 15,5%, восстановленного сахара - от 4 до 17,7%, тирозина - от 2,43 до 3%, триптофана - от 0,96 до 3,82%, аргинина - от 4,1 до 5,71%, липидов от 16,8 до 37,3%, фосфолипидов - от 2,86 до 3,36% и ДНК - от 0,5 до 2,5%. Максимальное содержание липидов (37,3%) установлено в антигенной фракции, полученной без эфирной обработки, т. е. при минимальных потерях липидов, а минимальная величина (16,8%) выявлена в осадке центрифугата, содержащем главным образом триптофан и аргинин, т. е. субстраты белковой природы.
Белковая природа видоспецифической фракции подтверждается ее высокой лабильностью при нагревании. Методом хроматографии на бумаге установлено наличие в составе белковых фракций риккетсий Бернета 15 основных аминокислот (Smith, Stoker, 1951). На двухфракционный состав антигена риккетсий Провачека указывают Л. И. Райхер с соавторами (1963), которые с помощью электрофореза на бумажных полосах при разных способах выделения растворимого антигена обнаружили 2 белковые фракции (А и Б). Растворимый антиген фракции А не обладал видовой специфичностью, а антиген фракции Б имел четко выраженную видовую специфичность.
Сложный фракционный состав имеют антигены риккетсий Бернета. Так, в соответствии с данными Anacker и соавторов (1961) при фракционировании риккетсий Бернета можно выделить клеточную оболочку и цитоплазму. Максимальной антигенностью обладает оболочка (640 - 1280 комплементсвязывающих единиц в 1 мг) и очень незначительной - цитоплазма (10 - 20 ед/мг), тогда как цельные риккетсии занимают среднее, промежуточное положение по степени комплементсвязывающей активности (320 ед/мг).
Риккетсиозная мембрана играет исключительную роль в биологической характеристике риккетсий. Кроме антигенности, с функцией мембраны связывают гемолитическую активность, токсичность и патогенность риккетсий. Так, максимальной токсичностью обладают цельные риккетсии или их оболочки, которые примерно в 120 раз токсичнее вироплазмы риккетсий. Нагревание до 60° в течение 30 минут и обработка формалином в концентрации 0,375% разрушают токсин. Центрифугирование при 1000 об/мин в течение 5 минут не снижает токсической активности нативных суспензий, но при центрифугировании в течение 1 часа при 4000 об/мин токсин переходит в осадок, что свидетельствует о его прочной связи с риккетсиозными корпускулами. После фильтрования риккетсиозных суспензий через фильтры Беркефельда N в фильтрате, в котором отсутствуют риккетсии, токсин не обнаруживается, что также свидетельствует о его связи с корпускулой риккетсий.
Итак, особенность риккетсиозных токсинов заключается в их тесной связи с корпускулой риккетсий и высокой лабильностью, что указывает на белковую природу токсинов. Утрачивая токсические свойства при нагревании, токсин сохраняет, однако, иммунизирующие свойства. Обладая антигенными свойствами, токсическое вещество риккетсий нейтрализуется специфическими иммунными сыворотками.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'