Глава 5. Метаболизм риккетсий
Изучение структуры риккетсий позволило установить наличие у них витаминов и ферментов, обеспечивающих и регулирующих метаболизм.
Первые наблюдения в отношении ферментной активности риккетсий касались окисления некоторых субстратов. Так, Bovarnick с соавторами (1949, 1950, 1954) на примере риккетсий Провачека (штаммы E и Брейнль) и риккетсий Музера (штамм Вильмингтон) экспериментально показали, что очищенные дифференциальным центрифугированием и обработкой эфиром риккетсии потребляют кислород в присутствии гидролизата казеина и в большем количестве в присутствии глютаминовой кислоты с образованием конечного продукта окисления - двуокиси углерода. В меньшей степени потребление кислорода выражено в присутствии пирувата и сукцината. Вместе с тем показана корреляция между энзимной активностью риккетсий и их токсичностью для мышей. В результате окисления глютамата образуются различные промежуточные соединения, количество которых возрастает при увеличении экспозиции. Окислительные процессы в присутствии риккетсий Музера протекают быстрее, чем с риккетсиями Провачека. Максимальное потребление кислорода риккетсиями Провачека в присутствии глютамата соответствует 13,6 мкМ за 5 часов, тогда как риккетсии Музера окисляют за это время до 33,6 мкМ. Кроме того, показана прямая зависимость жизнеспособности риккетсий от их окислительной активности. Так, окислительная активность нативных очищенных риккетсий Музера оказалась почти в 50 раз выше, чем активность культур после однократного замораживания.
Bovarnick установила связь между содержанием общего азота и скоростью окисления глютамата, а также зависимость между этими показателями и уровнем образования комплементсвязывающих антител и токсичностью суспензии риккетсий (Wisseman с соавторами, 1951). Эти показатели весьма убедительно определяют связь окислительной активности риккетсий с основными специфическими функциональными тестами их жизнедеятельности.
При окислении глютамата риккетсиями в одних случаях промежуточными и конечными продуктами являлись трикарбоновые кислоты и двуокись углерода, тогда как в других случаях происходило трансаминирование глютаминовой кислоты в аспарагиновую. Начальный период окисления заключался в окислительном дезаминировании глютаминовой кислоты с образованием альфакетоглютаровой кислоты при участии дегидрогеназы глютаминовой кислоты.
Промежуточные продукты окисления глютаминовой кислоты образовывались в случае подавления окисления кетоглютарата арсенатом и при подавлении окисления сукцината малонатом. Было установлено наличие у риккетсий Провачека окисления в системе: янтарная кислота - фумаровая кислота - яблочная кислота - щавеле - воуксусная кислота - пировиноградная кислота - аспарагиновая кислота. После окислительного дезаминирования глютаминовой кислоты последующее окисление происходило в соответствии с циклом Кребса.
У риккетсий Музера было выявлено окислительное декарбоксилирование альфа - кетоглютаровой кислоты, которое протекало только в присутствии дегидрогеназы кетоглютаровой кислоты с образованием сукцинил - коэнзима А, восстановлением дифосфопиридиннуклеотида (ДПН·H2) и выделением свободной двуокиси углерода. Коферментами реакции служили ди- и трифосфопиридиннуклеотид (ДПН и ТПН) и коэнзим А. В данном случае акцептором водорода является дифосфопиридиннуклеотид. Последующее образование янтарной кислоты наступало в результате расщепления сукцинил-коэнзима А в присутствии неорганического фосфора и гуанозиндифосфата (ГДА). Дегидрирование янтарной кислоты катализировалось ферментом сукциндегидрогеназой. Образовавшаяся при этом фумаровая кислота под влиянием фермента фумаразы превращалась в L - яблочную кислоту - Дегидрогеназа яблочной кислоты обеспечивала очередное дегидрирование, протекающее под влиянием ДПН и малатдегидрогеназы с образованием ДПН·H2 и щавелевоуксусной кислоты.
Следующий достоверно прослеженный этап окисления глютамата риккетсиями заключается в декарбоксилировании оксалацетата до пировиноградной кислоты.
Хорошо изучено окислительное действие риккетсий на пировиноградную кислоту. Спектрофотометрически продемонстрировано окисление восстановленного дифосфопиридиннуклеотида (ДПН·H2) очищенными риккетсиями в присутствии пировиноградной кислоты. Наиболее интенсивно окисление протекало в присутствии разрушенных ультразвуком риккетсий. Добавление в качестве реагента вместо риккетсий белкового преципитата из куриных эмбрионов резко снижало окисление ДПН·H2 в присутствии пировиноградной кислоты. В этих условиях скорость окисления приближалась к показателям, характерным для процесса, наблюдавшегося при отсутствии пировиноградной кислоты. В результате окисления риккетсиями пирувата образовывались аспарагиновая и молочная кислоты. В суспензиях было обнаружено также наличие дегидрогеназы молочной кислоты и трансаминазы. Однако следует учитывать, что дегидрогеназа молочной кислоты и трансаминаза являются составными частями тканей желточных оболочек куриных эмбрионов, в небольших количествах загрязнявших риккетсиозную суспензию. Несмотря на то что при использовании разрушенных риккетсий количество указанных энзимов возрастало, это еще не может служить окончательным подтверждением их риккетсиозной природы, так как может зависеть от адсорбции их из клеток хозяина на поверхности риккетсий. Однако подобная адсорбция свидетельствует о способности внутриклеточных возбудителей использовать энзимы клеток хозяина.
Дегидрогеназная активность очищенных риккетсий была выявлена в опытах Kohno (1959) при использовании в качестве акцептора водорода 2,6-дихлорофенол - индофенола. При этих условиях окислялось большинство представителей цикла Кребса, а ингибиторы типа малоната и арсениты подавляли дегидрогеназную активность риккетсий, тогда как добавление дифосфопиридиннуклеотида ускоряло дегидрогенацию глютамата. Ноуег с соавторами (1957) показали наличие у риккетсий Музера различных окислительных и восстановительных дыхательных пигментов и определили роль энзимов системы флавин - железо - цитохром (включая цитохромы A1 и B1) в окислительно-восстановительных реакциях.
О связи окислительно-восстановительных реакций риккетсий с их токсичностью, гемолитической активностью и вирулентностью свидетельствуют данные о том, что добавление иммунной сыворотки одновременно с нейтрализацией биологической активности риккетсий подавляет их окислительно-восстановительную способность Kohno, 1959; Price, 1953).
В ряде исследований было отмечено изменение скорости окисления глютамата риккетсиями под влиянием некоторых химических веществ. Так, Wisseman с соавторами (1951) показали стимулирующее действие ионов магния и марганца на скорость окисления глютамата и выявили оптимальную концентрацию ионов водорода (в пределах pH 7,32 - 7,90). Наибольший интерес представляют данные об ингибирующем действии ряда антибиотиков и химиотерапевтических веществ. Четко прослежено, что in vitro окисление глютамата угнетают только те вещества, которые оказывают выраженное риккетсиостатическое действие. Эти наблюдения позволяют заключить, что риккетсиостатическое действие антибиотиков связано с подавлением дыхания риккетсий.
Л. П. Зубок и В. А. Благовещенский (1957), Е. П. Савицкая и Л. П. Зубок (1961), изучая окислительную способность риккетсий Провачека в суспензии из легких белых мышей, показали, что риккетсии поглощают кислород в присутствии глютаминовой кислоты. Ткани незараженных белых мышей окислительной способностью не обладали, что свидетельствует о поглощении кислорода самими риккетсиями, т. е. о наличии у них фермента глютаминоксидазы. Максимальное поглощение кислорода происходило при 38°. Вместе с тем было прослежено ингибирующее действие биомицина и секазина на окислительную способность риккетсий. В опытах in vitro с очищенными риккетсиями была выявлена степень угнетения окислительной активности в зависимости от дозы антибиотика. Так, добавление 50 γ биомицина подавляло окисление на 7 - 8%, 100 γ - на 56% и 220 γ на 90%. Удаление биомицина из системы промыванием не восстанавливало исходной окислительной активности. Сходное действие на дыхание риккетсий оказал и секазин.
Snyder с соавторами (1954) определили, что ауреомицин и террамицин необратимо угнетают гемолитическую функцию риккетсий. Эти наблюдения позволяют предположить, что антибиотики либо тесно связываются с риккетсиозной клеткой, причем эту связь нельзя уже нарушить, либо вызывают необратимые изменения в ферментной системе риккетсий.
Интересные сравнительные данные получены Terada, Watanaba и Tamaki (1956), которые установили прямую зависимость между степенью ингибирующего действия разных антибиотиков и выраженностью их риккетсио-статического действия. Оказалось, что в наибольшей степени окисление глютамата угнетает ауреомицин и в значительно меньшей - хлорамфеникол, эритромицин и карбомицин. Эти исследования проливают свет на механизм действия антибиотиков на риккетсии, выражающийся в угнетении их дыхательной функции.
Поскольку многие авторы отметили при окислении глютамата риккетсиями Музера наличие в числе достоверно выявленных компонентов лимоннокислого цикла цитрата и цис-аконитата, то можно полагать, что для риккетсий характерен полный цикл Кребса. Весьма важным представляется и способность риккетсий к переаминированию аминокислот (глютаминовой и аспарагиновой) через цикл Кребса, что имеет существенное значение для синтеза специфических белков. Несмотря на отсутствие прямого доказательства, наличие трансаминазы подтверждается окислением риккетсиями глютамата в аспартат и отсутствием этого эффекта при добавлении вместо риккетсий очищенного преципитата тканей куриных эмбрионов или инактивированных замораживанием при - 20° риккетсий. Синтез аспартата увеличивается, если окисление происходит при одновременном добавлении глютамата и оксалацетата (соответственно 9,76 и 13,7 мкМ).
Hopps с соавторами (1956), пометив глютаминовую кислоту радиоактивным углеродом (C14), установили, что конечным продуктом ее окисления в риккетсиях является двуокись углерода (C14O2), а в результате переаминирования образуется аспарагиновая кислота. Таким образом, выяснен механизм синтеза риккетсиями необходимых им аминокислот. Кроме того, авторы показали, что очищенные суспензии из желточных оболочек куриных эмбрионов не содержат трансаминазы, тогда как в суспензии очищенных риккетсий ее постоянно обнаруживали. Содержание трансаминазы во взвеси риккетсий, разрушенных замораживанием и оттаиванием, было почти в 20 раз выше, чем в суспензии нативных риккетсий. Изучение механизма окислительных реакций позволило выявить способность риккетсий (на примере штамма E риккетсий Провачека) окислять глютамат в присутствии аденозиндифосфата (АДФ), гексокиназы и глюкозы с образованием некоторого количества глюкозо-6-фосфата (Bovarnick, 1956). Для максимального образования глюкозо-6-фосфата необходимо присутствие ДПН, коэнзима А, достаточно высокой концентрации АДФ и неорганического фосфата. Добавление цианистого калия в концентрации 10-4, который является ингибитором окисления, снижает образование глюкозо-6-фосфата до очень низких величин.
Неожиданностью оказалось высокое потребление кислорода при добавлении АДФ, обычно подавляющего окисление в использованных автором концентрациях. Аналогичные опыты с препаратом незараженных куриных эмбрионов (вместо очищенных риккетсий) показали, что потребление кислорода и образование глюкозо-6-фосфата специфично для риккетсий и практически не происходит в их отсутствие при наличии тканевых субстратов.
Bovarnick была установлена также зависимость образования глюкозо-6-фосфата и потребления кислорода от pH среды. Оказалось, что в нейтральной и слабо кислой среде окисление протекает быстрее, чем в щелочной среде. При замене АДФ адениловой кислотой или исключении из реакции гексокиназы глюкозо-6-фосфат не образуется.
Окислительное фосфорилирование, которое почти полностью предупреждается введением в систему ДПН, указывает на значительное сходство между риккетсиями и митохондриями, а также на автономность этой реакции от чужеродных фосфатакцепторных систем. В опытах с очищенной суспензией риккетсий Бернета Paretsky с соавторами (1958) показали аденозинтрифосфатазную активность возбудителя Ку-лихорадки. Оказалось, что активность очищенных риккетсий значительно выше, чем неинфицированных желточных оболочек, и находится в прямой зависимости от степени очистки препарата. Риккетсии, очищенные дифференциальным центрифугированием и целитом с дополнительной обработкой трипсином и антисывороткой к желточной оболочке, обладали наиболее выраженной АДФ-азной активностью (гидролиз АДФ).
Wisseman с соавторами (1951) показали способность риккетсий Бернета к окислению компонентов цикла трикарбоновых кислот. Эти данные вместе с выявленной АДФ-азной активностью риккетсий приближают к пониманию механизма синтеза цитрата возбудителем.
Paretsky с соавторами (1958) установили, что обработанные ультразвуком риккетсии Бернета обладают во много раз большей энзимной активностью, чем необработанные риккетсии. В этих же опытах был прослежен синтез цитрата в присутствии оксалацетата. Интересно, что в присутствии малата синтез не наступал. При использовании ацетил-фосфата вместо ацетата количество синтезированного цитрата было больше (соответственно 2 и 1,3 мкМ). Вместе с тем было установлено наличие глютаматдегидрогеназ и малатдегидрогеназ. Специфичность окислительных процессов характеризуется тем, что в присутствии оксалацетата риккетсии Бернета синтезировали 2,88 мкМ цитрата, тогда как при замене возбудителя клетками куриного эмбриона выход цитрата составлял всего 0,33 мкМ.
Наличие АТФ-азной и АДФ-азной активности свидетельствует о фосфорилирующей способности риккетсий, а также служит показателем, определяющим энергетический источник реакций этих возбудителей. Восстановление ДПН·H+ малатом и глютаматом в присутствии риккетсий определяет значение коэнзима в метаболизме риккетсий. Зависимость риккетсий от таких специфических коэнзимов, как ДПН+, АТФ и коэнзим А, определяет природу и степень паразитизма риккетсий Бернета.
В последующем был показан специфический характер окисления глюкозо-6-фосфата и изоцитрата. Так, Consign и Paretsky (1962) установили, что окисление глюкозо-6-фосфата риккетсиями Бернета сопровождается восстановлением тпн до ТПН·H+. При этом отмечена линейная зависимость скорости окисления, когда ДОД равнялось 0,0083 в минуту. Образование 6-фосфоглюконата как продукта окисления выявлено хроматографически Cohen и Scott (1950). Специфичность окисления изоцитрата с восстановлением ТПН до ТПН·H+ подтверждается опытами, в которых при замене трифосфопиридиннуклеотида дифосфопиридиннуклеотидом не наступало восстановления последнего. Контрольные опыты с использованием вместо взвеси живых риккетсий суспензии аналогичным способом очищенных желточных оболочек незараженных куриных эмбрионов с добавлением убитой культуры возбудителя показали, что окисление является специфическим процессом, присущим только живым риккетсиям.
Способность риккетсий окислять глюкозо-6-фосфат является важным энергетическим источником жизненных процессов организма. Окисление изоцитрата, кроме того, служит доказательством способности риккетсий Бернета к синтезу промежуточных элементов цитратного цикла трикарбоновых кислот.
Прямое окислительное превращение глюкозы или ее фосфорных эфиров (глюкозо-6-фосфата) в отличие от гликолиза начинается с окисления глюкозо-6-фосфата при участии дегидрогеназы, Коферментом этой реакции служит ТПН. Реакция протекает по следующей схеме (С. Е. Северин, 1962): глюкозо-6-фосфат дегидрогеназа/ТПН → глюкозолактон-6-фосфат →H2O+6- фосфоглюконовая кислота.
Указанная реакция аналогична реакции, установленной для риккетсий Бернета. Во время реакции происходит раскрытие пентозного цикла и образование фосфоглюконовой кислоты под действием лактоната. Помимо фосфоглюконовой кислоты, в результате окисления глюкозо-6-фосфата образуется восстановленная форма три - фосфопиридиннуклеотида (ТПН·H2). В конечном итоге при окислении глюкозо-6-фосфата из 6 молекул одна окисляется с образованием 6 молекул двуокиси углерода, при этом 12 молекул ТПН переходят в восстановленную форму:
6·Г-6-Ф+12·ТПН→6·CO2+12·ТПН·H+12H+ +H3PO4+5·Г-6-Ф
Непосредственным доказательством включения риккетсиями неорганического фосфора являются опыты Ноуег и Pickens (1962). При заражении куриных эмбрионов пятидневного возраста риккетсиями Бернета и одновременном добавлении разных доз (0,05, 0,125, 0,25 и 0,5 мК) ортофосфата - P32 авторы установили, что риккетсии, очищенные от тканей куриного эмбриона методом дифференциального центрифугирования в градиенте плотности и обработанные 1 М раствором хлористого калия, содержали до 70% радиоактивной пометки.
Одновременно с прямым окислением углеводов (пентозный цикл) риккетсии, по-видимому, обладают способностью к анаэробному расщеплению глюкозы (гликолиз). Так, Paretsky с соавторами (1962) обнаружили у риккетсий Бернета гексокиназу, т. е. фермент, осуществляющий процесс анаэробного расщепления глюкозы, начиная с ее фосфорилирования и образования глюкозо-6-фосфата. При инкубировании разрушенных риккетсий Бернета в течение 45 минут при 35° в присутствии 13,6 мМ глюкозы, 1,12 мМ аденозинтрифосфата, 0,091 мМ хлористого магния и 0,011 М гидроксиметил-аминометана при pH 7,5 было показано, что гексокиназа содержится не только в риккетсиях, но и в тканях незараженных желточных оболочек куриных эмбрионов, однако количество энзима в риккетсиях было значительно выше, чем в нормальной ткани. Наличие гексокиназы в тканях куриного эмбриона было показано до и после обработки целитом, но она отсутствовала после трипсинизации, что служит, кстати, доказательством белковой природы фермента. Если же после трипсинизации суспензию риккетсий разрушали ультразвуком, то удавалось вновь обнаружить гексокиназу. Эти наблюдения указывают на наличие в препарате энзимов как риккетсиозного, так и тканевого происхождения. Соответственно этому и синтез глюкозо-6-фосфата в присутствии карбоксил - фосфата был значительно выше в инфицированных тканях. Глюкозо-6-фосфат отсутствовал после обработки трипсином и ультразвуком в нормальных желточных мешках, но содержался в значительном количестве в зараженных тканях (53,1 мкМ). Участие карбоксил - фосфата в синтезе глюкозо-6-фосфата было изучено на разрушенных риккетсиях Бернета при инкубировании их в присутствии глюкозы, аденозинди-фосфата и карбоксил-фосфата, помеченного по фосфору.
Аналитически было установлено, что 0,53% исходной глюкозы превращается риккетсиями в глюкозо-6-фосфат под влиянием глюкозо-6-фосфат-дегидрогеназы. Достоверность синтеза глюкозо-6-фосфата риккетсиями в присутствии глюкозы и карбамил-фосфата (окислительное фосфорилирование глюкозы) подтверждена также подавлением синтеза глюкозо-6-фосфата специфическими ингибиторами типа АТФ, АДФ и аденозинмонофосфата (АМФ). Ингибирующее действие этих веществ на фосфорилирование гексокиназой показано многими авторами и на примере других живых систем. Приведенные данные свидетельствуют о том, что максимальный синтез глюкозо-6-фосфата происходит при 1 - 10 мМ АДФ. Увеличение ингибитора до 100 мМ полностью подавляет синтез при использовании убитых нагреванием и разрушенных риккетсий Бернета. Способность риккетсий сыпного тифа окислять глютамин в присутствии АДФ, глюкозы и экзогенной гексогеназы с образованием глюкозо-6-фосфата еще раньше была показана Bovarnick (1956). В настоящих же опытах доказано наличие фосфогексокиназы, эндогенной для риккетсий Бернета.
Роль карбоксил-фосфата не ограничивается участием в образовании глюкозо-6-фосфата. Так, Mallavia и Paret - sky (1963) установили способность очищенных риккетсий синтезировать аминокислоту цитруллин, используя карбамил-фосфат. При инкубировании разрушенных риккетсий в присутствии карбамил-фосфата и L-орнитина при pH 7,0 - 7,5 происходит синтез цитруллина, причем в цитруллин переходит около 12% карбамил-фосфата. Исследования Mallavia и Paretsky показали, что разрушенные риккетсии Бернета, подобно другим клеткам, утилизируют карбамил-фосфат для синтеза уреидосук-цината с превращением до 13% карбамил-фосфата в присутствии аспартата и АДФ. Таким образом, этими исследованиями выяснена способность риккетсий Бернета к транскарбамиляции - широко распространенной реакции различных живых клеток. Тот факт, что риккетсии Бернета обладают энзимной потенцией синтезировать цитруллин и уреидосукцинат, позволяет полагать, что у них могут иметься и другие энзимы цикла метаболизма мочевины.
Итак, указанные исследования показали способность риккетсий Бернета независимо от энзимов клетки хозяина утилизировать карбамил-фосфат для автономного синтеза важной аминокислоты - цитруллина. Риккетсии Бернета оказались способными превращать цитруллин в аргинин с синтезом 1,04 мкМ аргинина на 1 мг азота риккетсий при коэффициенте полезного действия реакции 5%. Интересно, что синтез уреидосукцината через карбамил-фосфат и аспартат напоминает синтез его у некоторых бактерий, например у кишечной палочки и стрептококка. Способность к синтезу уреидосукцината четко продемонстрирована в опытах с пометкой продуктов метаболизма аспартата и карбамил-фосфата с помощью радиоактивного углерода. Способность к синтезу этих двух соединений выявила наличие у риккетсий транскар-бамилаз. Более того, самостоятельный синтез уреидосукцината является важным моментом, раскрывающим механизм биосинтеза пиримидинов. Таким образом, этими исследованиями выявлена способность риккетсий синтезировать пиримидиновых предшественников.
Установление у риккетсий окислительно-восстановительных реакций по лимоннокислому типу (цикл Кребса) позволило выявить у них наличие различных ферментов и витаминов, необходимых для катализации процесса обмена веществ. Вместе с тем более доказательным подтверждением наличия энзимов и витаминов оказались прямые наблюдения Kleinschmidt с соавторами (1956), которые установили, что никотиновые кислоты и рибофлавин присутствуют у риккетсий в относительно высоких количествах. Kleinschmidt с соавторами также подтвердили ранние наблюдения Bovarnick о связи ДПН с никотиновой кислотой при реактивации риккетсий. Наличие витамина B6 и тиамина у риккетсий согласуется с данными о способности их кпереаминированию, декарбоксилированию и окислительному фосфорилированию. Количественный подсчет молекул витаминов на каждую корпускулу риккетсий или единицу азота позволил вывести зависимость, выражающуюся в том, что содержание никотиновой кислоты, рибофлавина, витамина B6 и тиамина значительно выше, чем других витаминов (табл. 7).
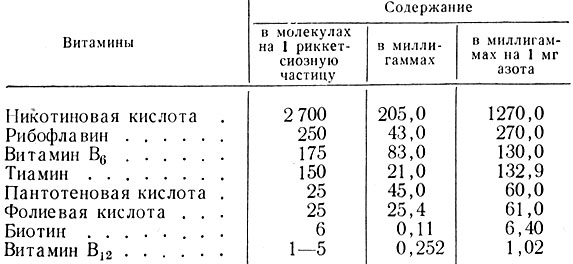
Таблица 7. Содержание витаминов в очищенных препаратах риккетсий Музера (по Kleinschmidt с соавторами, 1956)
Содержание витаминов в тканях незараженных куриных эмбрионов значительно ниже. Количественное различие содержания витаминов возрастает по мере очистки риккетсий, причем очищенные риккетсии содержат несоизмеримо больше витаминов, чем ткани. Наличие у риккетсий Бернета фолиевой кислоты и ее дериватов было установлено Myers (1958), Paretsky с соавторами (1958, 1961, 1963) и Mattheis, Silverman и Paretsky (1963). Фракционируя на колонках с ДЕАЕ-целлюлозой препараты риккетсий Бернета, Mattheis с соавторами (1963) обнаружили несколько дериватов фолиевой кислоты и показали, что снижение концентрации фолатов в тканях инфицированных куриных эмбрионов, по-видимому, зависит от их включения в размножающиеся риккетсии для участия в метаболизме, хотя не исключается и способность риккетсий в некоторых случаях самостоятельно синтезировать фолиевую кислоту. Применение для изучения физиологии риккетсий радиоактивных изотопов в качестве маркеров различных соединений позволило глубже познать природу и механизм метаболических процессов, протекающих в риккетсиях. Проведенные в этом направлении исследования выявили способность риккетсий не только к энергетическим, метаболическим окислительно-восстановительным реакциям, декарбоксилированию и трансаминированию, но и К включению в состав риккетсиозной клетки некоторых аминокислот и других веществ, необходимых для синтеза протеинов и липоидов. Так, Bovarnick с соавторами (1959) и Fujita с соавторами (1959), инкубируя очищенные риккетсии при 30° в сложной синтетической среде, содержащей 20 аминокислот, 8 солевых компонентов, кофакторы (ДПН, ТПН, АТФ, коэнзим А и др.), 16 витаминов, нуклеозиды, альбумин бычьей сыворотки и протеин желточных оболочек куриных эмбрионов, при pH 6,9 - 7,0 с добавлением метионина, помеченного по S35, установили способность риккетсий Провачека усваивать метионин.
Убитые нагреванием риккетсии оказались неспособными усваивать метионин, в то время как очищенные живые риккетсии потребляли его в прогрессивно повышающихся количествах в зависимости от экспозиции. На скорость потребления метионина оказывала влияние температура инкубации. Так, при 35° количество усвоенного риккетсиями метионина было в 3 раза больше, чем при 8°. Изучение наиболее оптимальных условий для потребления метионина позволило установить, что последовательное удаление из основной среды ДПН, коэнзима А, протеина желточных оболочек, цистеина, глютамина, глютамата, некоторых аминокислот, пуриновых и пиримидиновых оснований приводит к соответствующему количественному изменению уровня усвоения метионина. Дальнейшими исследованиями Bovarnick и Schneider (1960), Myers и Paretsky (1961) была показана способность риккетсий усваивать одни и синтезировать другие аминокислоты. Помеченный радиоактивным углеродом глицин-1-C14 усваивался риккетсиями в присутствии глютамина, серина, метионина, рибонуклеотидов, ионов калия, аденозин-5-трифосфата. Оптимальное количество потребляемого глицина за 24 часа эквивалентно включению 0,37 - 0,74 мг на 1 г протеина риккетсий. Включение глицина полностью угнеталось в присутствии цианистого калия, динитрофенола и фтористого калия. Хлорамфени - кол в дозах 6 - 32 γ/мл подавлял включение глицина в 5 - 30 раз, а добавление к среде парааминобензойной кислоты не влияло на усвоение риккетсиями глицина, что еще раз свидетельствует о корреляции риккетсиостатического действия некоторых химиотерапевтических веществ и метаболической активности риккетсий.
В соответствии с данными Myers и Paretsky (1961) при инкубации препарата энзимов из очищенных риккетсий Бернета при 35° в течение 2 часов в присутствии глицина-2-C14, раствора тетрагидрофолиевой кислоты, формальдегида, АТФ - пиридоксал-фосфата и трихлоруксус-ной кислоты образовывался серин.
Химизм образования серина иллюстрируется следующей формулой:
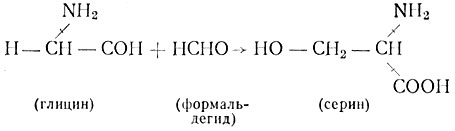
Результаты опытов Myers и Paretsky свидетельствуют о способности риккетсий к гидроксиметиляции глицина in vitro с образованием серина и участии производных фолиевой кислоты (тетрагидрофолиевой кислоты) в синтезе аминокислот. Не менее важные данные получены Bovarnick (1960) при инкубации очищенных риккетсий Провачека в системе с добавлением ацетат-1-C14. Включение ацетата при 30° через 5 - 24 часа составляло в двух опытах 2,4 и 14 у уксусной кислоты на 1 г риккетсиозного протеина, в то время как препарат из желточных оболочек и убитые нагреванием риккетсии не усваивали ацетат. Для определения субстрата риккетсий, усваивающего помеченный ацетат, риккетсии фракционировали и определяли активность по C14 различных фракций. При этом установлено, что почти весь радиоактивный углерод (ацетат-C14) содержался в липидах, тогда как при включении глицина-C14 последний содержался в протеине. С установлением включения ацетата в липиды показана способность риккетсий к самостоятельному углеводному, белковому и липоидному обмену, а также к автономному синтезу некоторых веществ.
Проведенные исследования обменных процессов, протекающих в риккетсиях при участии большого числа энзимов и витаминов, свидетельствуют о способности риккетсий не только усваивать готовые продукты метаболизма, но и самостоятельно их синтезировать. О взаимосвязанности обменных процессов клеток макроорганизма и риккетсий свидетельствуют наблюдения Paretsky с соавторами (1964), установивших значительное повышение в печени зараженных риккетсиями Бернета морских свинок содержания липидов и фосфорилазы (в 3 - 5 раз).
Как известно, в живой системе - клетке, способной к автономному метаболизму, процесс усвоения углеводов, белков и жиров в конечном итоге завершается в стадии метаболического цикла Кребса. Из представленной на рис. 12 схемы цикла Кребса видно, что конечными продуктами расщепления углеводов, белков и жиров являются трикарбоновые и пировиноградная кислоты. Способность риккетсий к автономному окислению всех членов цикла трикарбоновых и пировиноградной кислот, а также их способность синтезировать аминокислоты и липиды свидетельствуют о высокой биохимической организации риккетсий. Окисление у риккетсий проходит по тому же циклу, что и у животных, с образованием цитрата, двуокиси углерода, воды и с переаминированием глютаминовой кислоты в аспарагиновую при наличии других промежуточных компонентов. Метаболические процессы, протекающие в риккетсиях, позволяют риккетсиям синтезировать многие пластические вещества и создавать энергетические ресурсы, необходимые для поддержания основных функций жизнедеятельности.
Обнаружение у риккетсий метаболических процессов, связанных с окислением продуктов обмена до образования воды и углекислоты с выделением свободной АТФ или ГТФ (в частности, в стадии окисления альфа-кето-глютарата в сукцинат или образование глюкозо-6-фосфата), свидетельствует о их самостоятельной энергетической активности, необходимой для синтеза ряда жизненно важных для риккетсий субстратов.
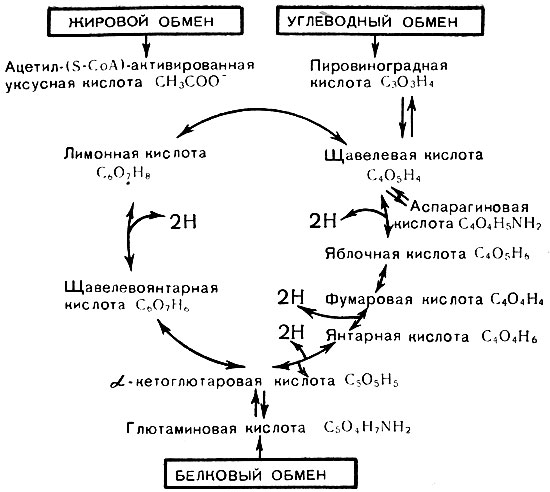
Рис. 12. Схема цикла Кребса, прослеженного в метаболизме риккетсий
Итак, риккетсиям присущи многие обменные процессы, в том числе окислительное фосфорилирование углеводов, окислительно-восстановительные процессы, декарбоксилирование и трансаминирование аминокислот, усвоение и синтез аминокислот и липидов. Особенно важным обстоятельством для понимания природы риккетсий является их способность in vitro включать аминокислоты с образованием протеинов. Это наряду со способностью к синтезу первичных элементов нуклеиновых кислот служит доказательством наличия у риккетсий автономного обмена веществ, что приближает их к бактериям. Облигатный паразитизм в клетках живых организмов указывает только на утрату в процессе эволюции некоторых энзимных систем, необходимых в синтезе всех субстратов, требующихся для композиции риккетсий. Сложный химический состав и четко выраженная метаболическая активность риккетсий определяют особенности их как класса микроорганизмов, занимающего промежуточное положение между вирусами и бактериями.
Наличие у риккетсий сложной энзимной системы и способности к самостоятельному синтезу некоторых веществ послужило основанием к изучению возможности их выращивания на питательных средах, лишенных живых клеток, но содержащих в своем составе большой набор необходимых для метаболизма компонентов. Первые исследования в этом направлении были предприняты еще в 1943 г. А. В. Пшеничновым, Б. И. Райхером и А. А. Петровой, которые, применив авитализированную питательную среду КЖМ, содержащую дефибринированную кровь, обезжиренное молоко и желток куриного эмбриона, добились размножения на ней риккетсий волынской лихорадки. Следует, однако, отметить характерную особенность этого возбудителя, заключающуюся в том. что при заражении вшей он заселяет просвет кишечника и размножается внеклеточно. Это свидетельствует о его меньшей, чем у других видов риккетсий, зависимости от метаболизма клетки хозяина. В последующие годы авторы усовершенствовали питательную смесь путем включения в нее богатой белком и витаминами среды № 199, применяемой для выращивания клеточных культур, комплекса витаминов, дрожжевого диализата и манифестатора - фильтрата 25-дневной бульонной культуры B. mesentericus fuscus (А. В. Пшеничнов, А. А. Петрова, 1957; Р. А. Пшеничнов, Е. П. Иванова, 1963).
Улучшив состав среды КЖМ и усовершенствовав методику выращивания, Р. А. Пшеничнов и Е. П. Иванова (1957, 1963) получили стабильные культуры риккетсий волынской лихорадки и пароксизмального клещевого риккетсиоза. Применив авитализированную среду КЖМ, А. В. Пшеничнов, С. А. Печеркина и Е. П. Иванова (1963) впервые показали возможность адаптации к бесклеточной среде риккетсий Провачека. Возможно, что среда КЖМ явится прототипом синтетической бесклеточной среды, на которой удастся получить стабильные культуры риккетсий.
Приведенные данные служат подтверждением того положения, что риккетсии в процессе эволюции не утратили полностью энзимные системы и обладают достаточно выраженной метаболической активностью, позволяющей им размножаться не только в живых клетках, но и в бесклеточных системах.
Способность некоторых не патогенных для человека риккетсий (R. melophagi и R. pediculi Hamburg) расти на кровяном агаре подмечена еще Sikora (1940), что позволило ей отнести риккетсии к бактериям. Varela и Vargas (1963) на основании клинической, серологической и культуральной общности относят риккетсии Бернета и риккетсии квинтана в одну группу. Основным критерием для этого служит способность обоих возбудителей размножаться внеклеточно в организме переносчиков. Характер размножения риккетсий Бернета в культурах клеток с образованием в цитоплазме ограниченной вакуоли, в которой находятся корпускулы возбудителя, также свидетельствует о большой автономности метаболизма риккетсий Бернета, усваивающих определенные компоненты клетки хозяина и строго отделенных от клеточной протоплазмы мембраной вакуоли. Это положение хотя еще и остается спорным, однако заслуживает внимания.
Особый интерес представляют сообщения А. В. Пшеничнова, Б. И. Райхер и Р. А. Пшеничнова (1959) и Р. А. Пшеничнова и Н. А. Батаровой (1963) о существовании литического агента типа фага к некоторым патогенным риккетсиям, способным размножаться вне клетки (возбудители волынской лихорадки и пароксизмального клещевого риккетсиоза). Работая с многими партиями платяных вшей, зараженных разными дозами риккетсий волынской лихорадки методом эпидермомембран, авторы наблюдали, что применение обычных доз инфицирующего материала не обеспечивало заражения большинства насекомых. Полученные из этих вшей фильтраты суспензий обладали фагоподобным действием на риккетсии при последующем инфицировании насекомых культурой возбудителя с добавлением фильтрата. Специальными опытами была показана фильтруемость фагоподобного агента, специфичность его действия, инактивация нагреванием и отличие от воздействующих на риккетсии тканевых ингибиторов. Эти наблюдения свидетельствуют о наличии фага к риккетсиям, что сближает последние с бактериями. Суть полученных данных заключается в том, что фаги, являясь облигатными внутри - бактериальными паразитами, могут размножаться за счет пластических и энергетических ресурсов бактериальной клетки. Очевидно, что фаги к риккетсиям могут размножаться только при том условии, если последние обладают сложной энзимной системой и в той или иной степени автономным обменом. Это в свою очередь еще раз подчеркивает сходство риккетсий с бактериями. Таким образом, риккетсии обладают свойствами, объединяющими их как с вирусами, так и с бактериями.
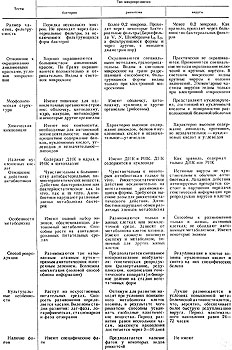
Как видно из данных табл. 8, риккетсии занимают промежуточное положение между бактериями и вирусами с преобладанием признаков, сближающих их с бактериями. Эти данные согласуются с современными представлениями о промежуточном положении риккетсий между вирусами и бактериями, что находит подтверждение в своеобразии их биологических свойств.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'