
Глава 6. Культивирование риккетсий
Изучение условий культивирования риккетсий и их взаимодействия с живой клеткой привлекает внимание многих исследователей на протяжении почти 60 лет.
Риккетсии, как уже указывалось, относятся к внутриклеточным паразитам, поэтому выращивание их на искусственных питательных средах, не содержащих живых клеток, все еще остается нерешенной задачей. Лишь в последнее время были получены данные, свидетельствующие о возможности выращивания некоторых видов риккетсий на искусственной среде КЖМ (А. В. Пшеничнов и соавторы, 1963).
Успешное культивирование риккетсий стало возможным после выявления условий их воспроизведения в органах инфицированных животных, членистоногих, в тканевых культурах и в развивающихся куриных эмбрионах.
Разработка методов культивирования риккетсий в средах с переживающими тканями послужила основой для дальнейшего выяснения природы этих возбудителей и методов их выращивания. Выращивание риккетсий в культуре переживающих тканей, осуществленное Wolbach и Schlesinger (1923), В. А. Барыкиным и Н. Крич (1922), А. А. Кронтовским (1922), Nigg, Landsteiner (1930), Zinsser с сотрудниками (1937, 1939), Burnet (1938), Сох и Bell (1938), Л. В. Васильевой (1948) и другими исследователями, с использованием методов и сред Карреля, Мейтландов, а также более сложных сред позволило получать чистую культуру риккетсий и использовать ее для приготовления диагностического антигена и специфических вакцин. Однако указанные методы из-за сложности, нестандартности и малой продуктивности явились лишь начальным этапом в разработке более рациональных и простых способов получения чистой культуры возбудителя и в настоящее время используются для изучения только некоторых биологических особенностей риккетсий.
Большие перспективы представляет выращивание риккетсий в культуре живых клеток. Еще в 1923 г. Carrel получил устойчивую культуру живых клеток фибробластов куриного эмбриона, поддерживавшуюся в течение 13 лет. Однако только после опытов Feller, Enders, Weller (1940) этот метод нашел практическое применение для выращивания вирусов и риккетсий.
Bozeman с сотрудниками (1956,1957), Roberts и Downs (1959) успешно применили для выращивания риккетсий размножающиеся клетки лимфобластов мышей (штамм MB III), фибробластов мышей (L - 929), крыс (14 pf) и куриных эмбрионов в питательной среде, содержащей 40% сбалансированного солевого раствора Гея, 10 - 20% тканевого эмбрионального экстракта, 40 - 50% лошадиной сыворотки, 0,005% фенолрота, 100 ЕД/мл пенициллина и 20 мг/мл стрептомицина. Было установлено, что при выращивании возбудителя лихорадки цуцугамуси в клетках MB III, инкубированных при 37°, уже в первые 24 часа количество возбудителя увеличивается в 3 раза, причем через 3 - 5 дней, как правило, поражается 90 - 100% клеток. В культуре клеток MB III поддерживать рост риккетсий Провачека, Музера, Риккетса и Бернета удавалось только в том случае, если среда культивирования не содержала антибиотиков. Изучая условия выращивания риккетсий цуцугамуси и риккетсий Риккетса в культуре клеток штамма 14 pf и L - 929, авторы установили некоторые закономерности размножения риккетсий и определили способность риккетсий цуцугамуси расти в клетках L - 929 при 25, 35 и 40°. Однако при температуре 25 и 40° рост риккетсий в культурах был в значительной степени замедлен. При выращивании риккетсий цуцугамуси и риккетсий Риккетса в клетках 14 pf был отчетливо прослежен цитопатогенный эффект, более выраженный при заражении клеток возбудителем пятнистой лихорадки Скалистых гор. Дегенеративные изменения в клетках при заражении риккетсиями Риккетса наступали на 5 - 6-й день, цитопатогенный эффект в клетках, зараженных риккетсиями цуцугамуси, отмечался на 8 - 9-й день, при этом происходила утрата клетками полигональности, округление и дезинтеграция. Риккетсии из разрушенных клеток переходили в питательную смесь и находились там в броуновском движении.
В опытах О. С. Гудимы (1960, 1961) выращивание риккетсий Бернета (штамм Грита) в основном проводилось в культурах клеток HeLa. Оценивая накопление возбудителя в тканевой фазе и во всем содержимом культур, О. С. Гудима показал, что содержание риккетсий в клетках почти в 100 раз выше, чем в жидкой фазе культуры, что зависит от накопления риккетсий только в клетках, составляющих по весу примерно 1/200 - 1/400 часть всего объема культур. При выращивании риккетсий Бернета в клетках HeLa не было отмечено значительных различий в проценте поражения клеток в зависимости от температуры инкубирования (32, 35,6 и 37,2°), хотя несколько лучший рост риккетсий отмечался при 35,6°. Интересные данные получены при заражении культуры клеток HeLa различными дозами возбудителя. Так, при внесении в культуры 108 - 106 ID50 риккетсий в клетках уже на 2-е сутки четко обнаруживались риккетсии, а на 7 - 10-е сутки количество пораженных клеток превышало 50%. Введение в культуру клеток инфицирующего материала в дозе 105 - 104 ID50 вызывало в более поздние сроки поражение от 1 до 25% клеток. В случае введения 103 - 102 ID50 риккетсий, как правило, заражения клеток не происходило. Максимальная концентрация возбудителя в тканевой фазе культуры клеток HeLa достигалась при заражении дозами 108 - 107 ID50 и составляла 1,78·109-5,62·109 ID50 (для белых крыс).
По данным О. С. Гудимы, клетки СОЦ, КВ, HeLa, HEp - 2, ПК (почки кролика), TK (зобная железа кролика), CK (селезенка кролика) почти одинаково чувствительны к заражению возбудителем Ку-лихорадки. Клеточные штаммы ЛЧ (ткань легкого эмбриона человека), ФЧ (культура фибробластов из мышечной ткани эмбриона человека), ЛУК (клетки лимфатического узла кролика) оказались менее чувствительными, так как риккетсии Бернета в них накапливались всегда в меньших концентрациях (примерно в 5 - 10 раз), чем в клетках HeLa. В процессе пассирования риккетсий Бернета в культуре клеток HeLa была отмечена четкая и устойчивая адаптация возбудителя из яичной культуры к новым условиям выращивания, причем отмечалось нарастание инфекционного титра культур после непрерывного пассирования возбудителя в клетках HeLa в течение 5-10-15 и 20 генераций. Начиная с 10 - го пассажа риккетсии Бернета накапливались в клетках HeLa в больших концентрациях, чем возбудитель, взятый непосредственно из куриных эмбрионов. Если при заражении клеток культурой из желточных оболочек куриных эмбрионов, содержащих до 108 ID50 возбудителя, в тканевой фазе не удавалось получать накопление риккетсий выше 5,62·109 ID50, то после 5 и особенно после 10 - 15 и 20 пассажей концентрация возбудителя была всегда выше 1010 ID50. Характерной особенностью риккетсий Бернета явилось максимальное накопление возбудителя в клетках на 10 - 12 - 15-е сутки после заражения, тогда как у риккетсий Провачека, по нашим данным и материалам И. Н. Кокорина с соавторами (1963), максимум роста риккетсий отмечается на 5 - 7-е сутки, причем на 8 - 9-й день наступает массовая дегенерация пораженных клеток и снижение инфекционного титра культур. Длительное поддержание возбудителя Ку-лихорадки в тканевых культурах не привело к снижению вирулентности для морских свинок, однако риккетсии перешли из II фазы в I фазу (см. ниже).
В соответствии с данными О. С. Гудимы (1960), клетки могут использоваться для титрования риккетсий Бернета. С этой целью на 7-й день после заражения из пробирок извлекают слюдинки с находящимися на них клетками, которые фиксируют метиловым спиртом и окрашивают акридиновым оранжевым. В каждом препарате просматривают 100 полей зрения. Если обнаруживают 1 - 2 зараженные клетки, культуру считают инфицированной. Визуально определить пораженные клетки достаточно легко, так как риккетсии Бернета вызывают в клетках специфические изменения в виде вакуолей в цитоплазме. Статистически обработав полученные данные сравнительного титрования различных риккетсиосодержащих материалов на лабораторных животных (белых крысах) и культурах клеток, О. С. Гудима вывел поправочный коэффициент, равный 4,12 lgED50, который следует прибавлять к титрам, полученным при оценке активности на культурах клеток с тем, чтобы получить концентрацию, соответствующую результатам титрования на лабораторных животных. Применение этого метода оценки биологической активности риккетсиосодержащих культур позволяет в 3 раза сократить срок исследования.
Изучая условия роста риккетсий Бернета в культурах перевиваемой линии клеток из почки обезьяны, Pospisil (1965) показал их высокую чувствительность к риккетсиям, приближающуюся к куриным эмбрионам. На этом основании автор считает возможным рекомендовать титрование на клеточных культурах риккетсиосодержащих материалов для оценки биологической активности.
Наблюдая за динамикой размножения риккетсий Бернета в клетках HeLa, О. С. Гудима (1960) отметил, что в первые 1 - 2 суток после заражения культур возбудитель в клетках обычно не обнаруживается. Чаще всего на 3-и сутки в цитоплазме некоторых клеток появляются одна или несколько мелких вакуолей, содержащих риккетсии Бернета. Вакуоли четко отграничены от остальной цитоплазмы клеток, а риккетсии в них находятся в постоянном броуновском движении. В последующем размеры вакуолей увеличиваются; отдельные вакуоли сливаются в одну, которая постепенно заполняет почти всю цитоплазму, оттесняя ядро к периферии клетки. В это время клетки округляются и разрушаются, а возбудитель выходит в окружающую среду. При различных условиях культивирования О. С. Гудима ни в одном случае не обнаружил поражения всех клеток, тогда как при культивировании возбудителей эпидемического, крысиного и клещевого сыпного тифа, по нашим данным и наблюдениям И. Н. Кокорина с соавторами (1963), при использовании оптимальных доз возбудителя поражение 100% клеток наблюдается почти постоянно. В последнее время были предприняты попытки получения культуры ткани для выращивания риккетсий из членистоногих. Так, Rehácek и Brezina (1964) пришли к выводу о наибольшей восприимчивости к риккетсиям Бернета культуры ткани из клещей Haylomma asiaticum asiaticum.
При изучении закономерностей размножения риккетсий и динамики взаимодействия возбудителя с клеткой мы применили методику просмотра зараженных клеток в люминесцентном микроскопе с интервалом 6 - 12 часов. В этих опытах на примере штамма Брейнль риккетсий Провачека и штамма Брита риккетсий Бернета были прослежены некоторые особенности развития возбудителей в клетках HeLa, L, СОЦ, HEp - 2, в клетках сердца кролика (КС), сердца морской свинки (СМС) и в клетках амниона человека. Для заражения брали 1 - 2-суточные клеточные культуры с плотностью клеток 100 000 - 200 000 в пробирке. Инфицирующий материал из желточных оболочек куриных эмбрионов вводили в дозе 105 - 106 ID50 (ДЛЯ морских свинок) с питательной смесью (среда № 199 с 20% бычьей сыворотки для клеток HeLa и среда Игла с 5% бычьей или лошадиной сыворотки для остальных культур). После 24-часовой экспозиции вируса с клетками при 35,5° проводили повторную смену питательной смеси. Ежедневно после заражения из слюдинок с содержащимися на их поверхности клетками готовили препараты, фиксированные метиловым спиртом и окрашенные акридиновым оранжевым (1:30 000). Приготовленные препараты просматривали в иммерсионной системе люминесцентного микроскопа. Подсчет пораженных клеток и степень их инфицирования определяли по наличию риккетсий при просмотре 10 полей зрения по 100 клеток.
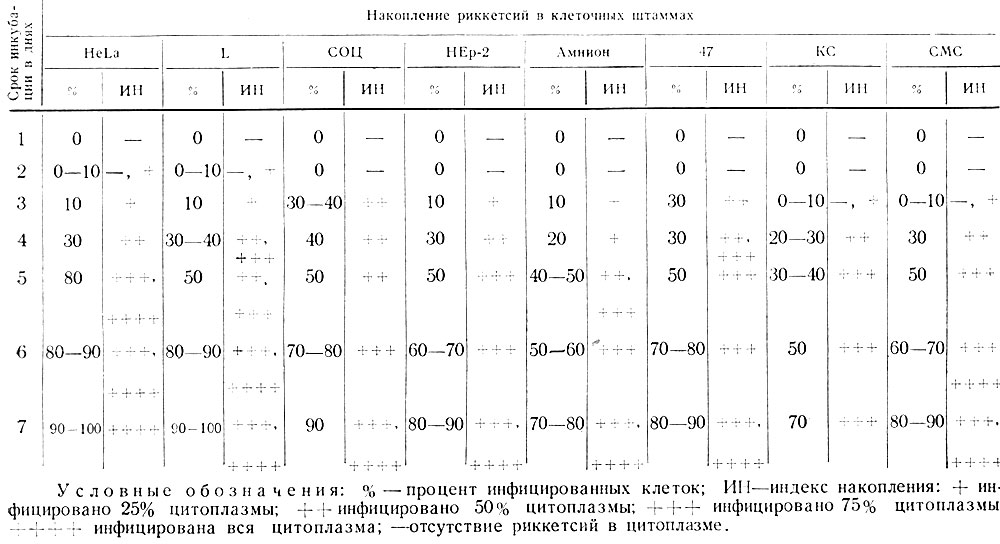
Таблица 9. Сравнительная оценка размножения риккетсий Провачека в различных клеточных культурах (заражающая доза 105 - 106 ID50)
Условные обозначения: % - процент инфицированных клеток; ИН - индекс накопления: + инфицировано 25% цитоплазмы; ++ инфицировано 50% цитоплазмы; +++ инфицировано 75% цитоплазмы; ++++ инфицирована вся цитоплазма; - отсутствие риккетсий в цитоплазме.
Приведенные в табл. 9 средние данные 2 - 4 опытов свидетельствуют, что в первые 48 часов в клетках, как правило, не удавалось обнаружить риккетсий, однако почти во всех случаях можно было видеть адсорбировавшиеся на поверхности клеток частицы возбудителя. Начиная с 3-го дня в клетках практически всех изучаемых штаммов были обнаружены риккетсии. Максимальное накопление возбудителя достигалось на 5 - 7-е сутки, когда поражалось 50 - 90% клеток. Во всех изученных клеточных штаммах риккетсии Провачека размножаются достаточно хорошо, однако некоторые из тканевых культур содержат включения, которые при аноптральной и фазовоконтрастной микроскопии не отличаются от риккетсий. Поэтому последующее изучение механизма и динамики взаимодействия риккетсий и клетки проводили со штаммами L и HeLa, в которых не содержатся оптически однородные с риккетсиями включения. Материалы изучения чувствительности клеток к разным дозам возбудителя и необходимого для заражения клеток времени их контакта с риккетсиями показывают, что при внесении 105-106 ID50 риккетсий (разведение суспензии желточных оболочек куриных эмбрионов 1:100) и контакте риккетсий с клетками в течение 24 часов возбудитель обнаруживается на 3-и сутки после инфицирования и к 6 - 7-му дню содержится в 90 - 100% клеток. Клетки, цитоплазма которых полностью заполнена риккетсиями, разрушаются, а риккетсии выходят в питательную смесь (см. рис. 8, 9, 10). При заражении культуры дозой 104-105 ID50 (разведение 10-3) риккетсии обнаруживаются в клетках лишь с 6 - 7-го дня. При внесении риккетсий в дозе 103 ID50 (разведение 10-4) заразить культуру клеток L не удавалось. При экспозиции от 15 до 60 минут с последующим удалением риккетсий путем замены питательной смеси возбудитель в клетках обнаруживается не ранее 4-го дня, однако при увеличении времени контакта до 24 часов возбудитель может быть обнаружен в клетках на 3-й и даже на 2-й день. В случае непродолжительной экспозиции (15 - 20 минут) в последующие 3 - 5 дней происходит медленное накопление риккетсий, при этом на 5-й день поражается только 20 - 30% клеток, тогда как при более длительном контакте к этому времени поражается 60 - 80% клеток. В данном случае лишь к 6 - 8-му дню содержание риккетсий в клетках становится одинаковым вне зависимости от времени предварительного контакта возбудителя с клетками. В случае инфицирования культур разведением 10-3 возбудитель удавалось обнаружить лишь при контакте вируса с клетками в течение 12 - 24 часов и то не ранее 6 - 8 суток после заражения.
Проведенные нами исследования по изучению взаимодействия риккетсий и клеток позволили получить данные, совпадающие с высказыванием Kordova и соавторов (1959, 1960) о наличии при размножении риккетсий стадии, когда возбудитель не удается обнаружить в заведомо инфицированных клетках (эклипс-фаза). Продолжительность эклипс-фазы не является постоянной и зависит от степени инфицирования клеток, т. е. от продолжительности контакта клеток с возбудителем, а также от инфицирующей дозы. Вместе с тем показано различие характера накопления риккетсий Провачека и риккетсий Бернета. Если последние образуют вакуоли, в которых содержатся скопления риккетсиозных частиц, то риккетсии Провачека расположены диффузно, преимущественно в околоядерной зоне, постепенно распространяясь к периферии клетки (см. рис. 8, 9, 10). При заражении клеток риккетсиями одновременно могут образовываться 2 - 3 и более фокусов размножения, которые впоследствии сливаются и при заполнении всей цитоплазмы приводят к разрушению клетки.
В литературе отсутствуют четкие указания на цитопатогенное действие риккетсий, хотя наблюдение за размножением риккетсий в культуре клеток позволяет сделать заключение о выраженном цитопатогенном действии риккетсий на клетки. Этот феномен, однако, имеет несколько иной характер, чем при заражении клеток вирусами, которые очень быстро размножаются и образуют четкие негативные колонии, т. е. участки разрушенных клеток. Поскольку у риккетсий период максимального накопления возбудителя занимает 5 - 7 дней (а не 48 - 72 часа, как у вирусов) и носит характер не одновременного, а последовательного поражения клеток, то и феномен образования негативных колоний в зараженных риккетсиями тканевых культурах проследить не удается. Однако при микроскопии неинфицированных и зараженных клеточных культур очень часто можно наблюдать более раннее отслоение инфицированного клеточного пласта и более длительное переживание клеток в контроле. В соответствии с нашими исследованиями культура риккетсий Провачека, адаптированная к выращиванию в клетках желточных оболочек куриных эмбрионов, сравнительно плохо приспосабливается к росту в культуре клеток, и после ряда субпассажей наступает полное истощение культуры. Для проведения субпассажей использовали клеточную культуру в момент максимального размножения в ней риккетсий до начала отслаивания клеток и выхода из них возбудителя.
При пассировании риккетсий Провачека в культуре клеток HeLa возбудитель обнаруживался лишь в первых 2 - 3 субпассажах и не выявлялся в последующих (табл. 10).
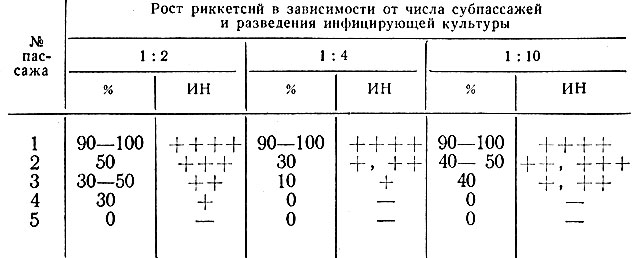
Таблица 10. Размножение риккетсий Провачека при пассировании в культуре клеток HeLa
Примечание. Обозначения те же, что и в табл. 9.
Постепенное уменьшение процента инфицированных клеток и в конечном итоге полное истощение культуры при пассировании свидетельствуют о консерватизме свойств риккетсий и трудности адаптации их к новым условиям выращивания, на что в свое время обращали внимание В. А. Барыкин (1935) и Cox (1938, 1940) при попытке адаптации культуры штамма риккетсий Провачека из легких белых мышей к желточным оболочкам куриных эмбрионов. Большие трудности возникли при адаптации к куриным эмбрионам также и возбудителя Волынской лихорадки (А. Т. Файдыш, 1950).
И. Н. Кокорин и соавторы (1963) при выращивании некоторых видов риккетсий в культурах клеток получили результаты, совпадающие с нашими наблюдениями. Авторы отметили, в частности, различный характер размножения возбудителя клещевого сыпного тифа в зависимости от клеточного штамма. Так, в клетках почечного эпителия наблюдалось изолированное поражение ядра клетки с развитием в нем характерных микроколоний возбудителя. При выращивании риккетсий в культуре клеток HEp - 2 вначале обнаруживались единичные риккетсии палочковидной и нитевидной формы, количество которых в последующие дни нарастало. Позднее образовались колонии, заполняющие всю цитоплазму. Была установлена также зависимость накопления возбудителя в клетках от величины инфицирующей дозы при заражении риккетсиями Провачека, Музера и возбудителем клещевого сыпного тифа. Наиболее оптимальные условия для размножения риккетсий в культурах клеток обеспечивались при внесении культуры из желточных оболочек куриных эмбрионов в разведении 1:100-1:200. При заражении менее концентрированной культурой количество инфицированных клеток снижалось от 100% (при использовании разведения 10-2) до 10 - 20% (при разведении 10-4-10-7). Максимальное накопление возбудителя достигалось в клетках почечного эпителия, оно в 100 раз превышало содержание риккетсий в куриных эмбрионах и было в 1000 раз выше, чем в культуре клеток HEp - 2. В культуре клеток HEp - 2 инфицирование всех клеток риккетсиями Провачека и Музера было получено в 9 последовательных пассажах, а возбудителем клещевого сыпного тифа - в 12 пассажах. На этом основании авторы делают вывод об адаптации риккетсий к клеткам.
Почти одновременно с разработкой методов выращивания риккетсий в переживающих, первично трипсинизированных и перевиваемых клетках изучались условия и возможности культивирования риккетсий в некоторых тканях развивающихся куриных эмбрионов.
Исследованиями Levaditi (1906), Rous и Murphy (1911), Goodpasture, Woodruff, Buddingh (1931), Zia (1934) и других исследователей были заложены основы методики культивирования вирусов и риккетсий на хорионаллантоисной оболочке развивающихся куриных эмбрионов, однако этот способ при выращивании риккетсий не нашел широкого практического применения. Причина неудач при культивировании риккетсий на хорионаллантоисной оболочке куриных эмбрионов (в отличие от успешного выращивания ряда вирусов) заключается, вероятно, в том, что для ряда вирусов характерна органотропность к эктодермальной ткани, какой и является хорионаллантоисная оболочка, тогда как риккетсиям свойственна элективность к эндо- и мезотелиальным тканям (А. П. Авцын, 1948; Я. И. Липкин, Ю. А. Потапчик, 1939). В настоящее время метод выращивания риккетсий на хорионаллантоисной оболочке может представлять интерес лишь при решении некоторых теоретических вопросов. Так, например, Litwin (1957) использовал метод заражения хорионаллантоисной оболочки риккетсиями для подсчета количества образовавшихся бляшек и гистологических исследований.
В 1920 г. Juan и Staub использовали метод культивирования некоторых микроорганизмов в полости желточного мешка куриного эмбриона. Однако в результате неудачных попыток авторов этот способ на долгое время был оставлен, и только в 1934 г. В. А. Барыкин с группой сотрудников вновь применили данную методику для культивирования риккетсий Провачека. Оказалось, что риккетсии Провачека хорошо развиваются в эмбрионах 4 - 6-дневного возраста, причем в желточных оболочках погибших куриных эмбрионов обнаруживается большое количество риккетсий.
Метод выращивания риккетсий, предложенный В. А. Барыкиным, привлек внимание отечественных и зарубежных исследователей. Уже в 1936 г. М. И. Мельник с соавторами и А. С. Виноградова сообщили о культивировании по методу Барыкина риккетсий Провачека и вируса бешенства. В 1938 г. Cox, обобщая данные по культивированию риккетсий и вирусов в желточных оболочках куриных эмбрионов, ссылается на методику В. А. Барыкина. Несмотря на это, приоритет В. А. Барыкина как первого исследователя, успешно решившего проблему культивирования риккетсий и вирусов в желточной оболочке куриного эмбриона, незаслуженно приписывается Cox, который осуществил лишь дальнейшую разработку указанного метода и использовал ее для выращивания ряда вирусов и риккетсий. В 1940 г. метод Барыкина с указанием на приоритет этого автора был применен Pang и Zia для выращивания риккетсий Музера.
В 1944 - 1948 гг. детальное изучение биологических особенностей выращивания риккетсий Провачека в куриных эмбрионах проводилось П. Ф. Здродовским. Оказалось, что зараженные куриные эмбрионы следует инкубировать при 36 - 37°, а для заражения яиц нужно использовать такую дозу маточного риккетсиозного материала, введение которой вызывает гибель эмбрионов с 6 - го дня при максимальном отходе на 7 - 9-й день после заражения. Сходные результаты были получены Л. В. Васильевой (1948) при культивировании риккетсий Музера. Автор заражала куриные эмбрионы суспензией из легких белых мышей и уже в первых субпассажах ей удалось адаптировать штамм к куриным эмбрионам и получать в желточных оболочках обильное накопление риккетсий, что свидетельствует о достаточно быстрой приспособляемости риккетсий Музера к выращиванию в желточных оболочках куриных эмбрионов, тогда как для адаптации риккетсий Провачека потребовалось более 20 пассажей. Сложной оказалась адаптация к куриным эмбрионам и возбудителя волынской лихорадки (А. Т. Файдыш, 1950).
В течение ряда лет Сох (1938, 1940, 1941, 1952) проводил большую работу по адаптации многих вирусов и риккетсий к куриным эмбрионам и определению оптимальных условий их выращивания. Оказалось, что риккетсии Ку-лихорадки, пятнистой лихорадки Скалистых гор, марсельской лихорадки и крысиного сыпного тифа относительно легко адаптируются к куриным эмбрионам, тогда как возбудитель эпидемического сыпного тифа удалось адаптировать с большим трудом лишь через 2 года после начала работ.
Определение оптимального температурного режима инкубирования инфицированных куриных эмбрионов явилось наиболее сложной и ответственной задачей. Различные авторы рекомендовали проводить инкубирование зараженных куриных эмбрионов при температуре 32 - 35° (В. А. Барыкин и др., 1935; Fitzpatrick, 1946), 36 - 37° (Л. В. Васильева, 1948; Cox, 1952) и даже 40° (Greiff и Pinkerton, 1945). Сох (1952) полагает, что большинство риккетсий, кроме группы клещевых лихорадок, хорошо размножается при 36°, тогда как, по данным В. А. Барыкина и Fitzpatrick, риккетсии группы сыпного тифа лучше растут при 35°.
При культивировании риккетсий в куриных эмбрионах следует учитывать, что от правильного выбора оптимальной температуры инкубирования инфицированных эмбрионов зависит накопление в них возбудителя. После первоначальных опытов Сох (1941) предложил единый температурный режим (37°) для выращивания риккетсий, однако в дальнейших исследованиях различных авторов была четко прослежена строгая зависимость роста риккетсий от температуры.
Как показали наши исследования, длительное пассирование риккетсий при неблагоприятных температурных условиях ведет к снижению накопления возбудителя и вирулентности культур. Исходные свойства возбудителя восстанавливаются после нескольких пассажей при оптимальных температурных условиях. Избирательная чувствительность отдельных видов риккетсий к определенным температурным режимам выращивания может служить критерием для их дифференцирования при культивировании в куриных эмбрионах, подобно тому как различаются некоторые представители группы оспы, образующие различные по форме и размерам бляшки на хорионаллантоисной оболочке в зависимости от температурных условий их культивирования в эмбрионах.
Указанный феномен, получивший название reproductive capacity temperature (rct - температура воспроизводящей способности), вполне применим и к риккетсиям. Действительно, как нам удалось проследить при выращивании риккетсий при различных температурных режимах, для каждого вида или группы риккетсий имеется температурный оптимум, при котором возбудитель развивается значительно лучше, дает более обильное и устойчивое накопление, чем при иных условиях инкубирования. Отклонение на 1 - 2° от оптимальной температуры инкубирования зараженных эмбрионов вызывает заметное снижение концентрации возбудителя. Особенно заметно влияние температурного режима инкубирования куриных эмбрионов выявляется при длительном пассировании риккетсий. В этом случае при неправильно выбранной температуре культуры риккетсий истощаются, тогда как при оптимальных условиях наступает последовательное повышение накопления возбудителя в результате адаптации к куриным эмбрионам.
Описанный признак максимального накопления риккетсий при оптимальных условиях инкубирования и истощения культур при иных температурных режимах может служить тестом, позволяющим дифференцировать различные риккетсии при их выращивании в куриных эмбрионах.
В табл. 11 представлены оптимальные температурные условия размножения трех групп риккетсий и отмечены различия в накоплении возбудителя в зависимости от температуры инкубирования инфицированных эмбрионов.

Таблица 11. Накопление различных риккетсий в зависимости от температуры инкубирования зараженных куриных эмбрионов
1 (Плюсы обозначают интенсивность накопления риккетсий)
При определении оптимального для заражения риккетсиями возраста эмбрионов большинство исследователей (П. Ф. Здродовский, 1948; Cox, 1952) рекомендуют использовать зародышей 7-дневного возраста. По данным Bengtson (1945), риккетсии одинаково хорошо размножаются в 6 - 8-дневных куриных эмбрионах. Применение зародышей 5-дневного возраста, по мнению ряда авторов, нежелательно, так как эмбрионы такого возраста очень чувствительны к изменению температурного режима, что определяет высокий процент неспецифической гибели эмбрионов в ранние сроки инкубации. Эмбрионы 9 - 10-дневного возраста менее чувствительны к риккетсиям и обеспечивают их скудное накопление (Beveridge и Burnet, 1956; Cox, 1938). В то же время Fitzpatrick (1946) полагает, что лучше пользоваться куриными эмбрионами 8 - 10-дневного возраста, так как при этом выход риккетсиосодержащего материала оказывается больше.
Все исследователи, изучавшие условия выращивания риккетсий, отмечают, что для стабильного получения активных культур очень важное значение имеет высокое качество маточных культур, которые должны содержать высокую концентрацию возбудителя и быть пригодными для длительного хранения без заметного снижения активности. В этом отношении большой интерес представляют исследования Craigie (1945), Ormsbee с соавторами (1955), Weiss с соавторами (1957), которые, используя 10 - 20% суспензию из желточных мешков зараженных куриных эмбрионов, в серии опытов определяли оптимальную инфицирующую дозу и хранили культуру при - 76°. Эта методика обеспечивала высокую стандартность маточной культуры в течение длительного времени. П. Ф. Здродовский (1948, 1956) рекомендует в качестве стандартного инфицирующего материала использовать культуры риккетсий, приготовленные из зараженных желточных оболочек, суспендированных в стерильном снятом молоке и высушенных методом лиофилизации из замороженного состояния. Заготовленный таким образом маточный риккетсиозный материал позволяет с успехом воспроизводить яичные культуры на протяжении многих месяцев и даже нескольких лет хранения при 4°.
Наши исследования (В. Н. Паутов, А. И. Полозов, 1961) свидетельствуют о выживании риккетсий Бернета в сухих культурах не менее 8 - 10 лет (срок наблюдения). При использовании для высушивания 10 - 20% суспензии из желточных оболочек на молоке, 10% растворе сахарозы с 0,1% агара и 1,25% желатины или 50% яичной суспензии на физиологическом растворе в процессе высушивания титр риккетсий снижается не более чем в 10 раз, тогда как в 0,1% суспензии из желточной оболочки на физиологическом растворе концентрация снижается более чем в 10 000 раз. В сухих 10 - 50% яичных культурах, приготовленных на молоке, физиологическом растворе или растворе сахарозы, агара и желатины и хранящихся при 4°, за 8 - 10 лет значительного снижения концентрации риккетсий не произошло. После длительного хранения патогенность риккетсий для морских свинок несколько уменьшилась, однако после пассажей на куриных эмбрионах свойства риккетсии восстанавливались и не отличались от свойств исходного штамма. Длительное выживание риккетсий Бернета (до 4 лет - срок наблюдения) отмечено в 20% суспензии из желточной оболочки, приготовленной на 10% растворе сахарозы с 0,1% агара и 1,25% желатины и хранящейся в замороженном состоянии при - 20°.
Большое значение при выращивании риккетсий в развивающихся куриных эмбрионах имеет концентрация вводимого в яйцо инфицирующего агента. В соответствии с данными Cox (1952), для каждого вида риккетсий следует использовать различные дозировки. Так, для риккетсий группы сыпного тифа и Ку-лихорадки рекомендуется использовать культуры желточных оболочек в разведении 10-4, для возбудителя марсельской лихорадки - в разведении 10-2, а для возбудителя пятнистой лихорадки Скалистых гор - всего лишь 1:50. Другие же исследователи отмечают, что хорошее накопление риккетсий в куриных эмбрионах обеспечивается при заражении яиц разведениями суспензии желточных оболочек от 10-1 до 10-5 в зависимости от исходной активности инфицирующего материала (Л. В. Васильева, 1948; Bengtson, 1945; Beveridge и Burnet, 1956). П. Ф. Здродовский (1956) указывает, что величина инфицирующей дозы по мере адаптации возбудителя к куриному эмбриону уменьшается, а накопление возбудителя повышается.
Продолжительность инкубирования зараженных куриных эмбрионов зависит от величины инфицирующей дозы. Так, по данным Л. В. Васильевой (1948), при заражении яиц суспензией желточных мешков куриных эмбрионов, инфицированных риккетсиями Провачека, в разведении 10-1, 10-3 и 10-5 гибель эмбрионов наступает соответственно на 3 - 8-й, 6 - 11-й и 11 - 14-й день. Аналогичные результаты приводит Bengtson (1945). Максимальное содержание риккетсий. Провачека в желточных оболочках зараженных куриных эмбрионов наблюдается непосредственно перед гибелью эмбрионов (Сох, 1948), тогда как наибольшее накопление риккетсий группы клещевых пятнистых лихорадок наступает приблизительно через 24 часа после гибели эмбрионов (Bell, Pickens, 1953; Stoenner и соавторы, 1962). Это различие, вероятно, зависит от того, что возбудители клещевых пятнистых лихорадок более патогенны для куриных эмбрионов и вызывают их гибель в более ранней фазе роста, чем риккетсии Провачека. Такое же различие наблюдается, кстати, и у вшей, инфицированных через кишечник, так как в момент гибели вши содержат больше риккетсий Провачека, чем риккетсий Риккетса (Weyer, 1954). Инфицирование вшей риккетсиями Провачека приводит к развитию смертельной инфекции, тогда как при заражении риккетсиями Бернета наступает инаппарантное носительство.
В случае применения чрезмерной заражающей дозы возбудителя куриный зародыш погибает в ранние сроки от интоксикации без накопления риккетсий. При заражении правильно выбранной дозой куриные эмбрионы погибают в более поздние сроки вследствие интенсивного риккетсиоза. В этих случаях гибель эмбрионов совпадает с максимальным накоплением в них риккетсий Провачека, Музера и Бернета. Рядом исследователей указывается, что изъятие погибших эмбрионов следует проводить в первые часы после их гибели, так как в противном случае наступает быстрое отмирание риккетсий из-за аутолиза (Craigie, 1945). В свете современных данных это положение, однако, нельзя считать универсальным для всех видов риккетсий и условий их выращивания.
Дифференцированный подбор оптимальных условий культивирования возбудителя позволил установить, что в силу своеобразия биологических свойств отдельных видов риккетсий существенно отличаются и оптимальные условия их выращивания. Известно, например, что риккетсии Бернета достаточно устойчивы к действию повышенных температур и поэтому в меньшей степени лизируются в погибших куриных эмбрионах при температуре 37°. Наиболее губительно сказывается инкубирование погибших эмбрионов на жизнеспособности риккетсий Провачека, обладающих повышенной лабильностью к воздействиям внешней среды. Существенным своеобразием отличаются условия культивирования возбудителей группы клещевых пятнистых лихорадок (пятнистой лихорадки Скалистых гор, марсельской лихорадки и возбудителя клещевого сыпного тифа Северной Азии), так как в погибших эмбрионах эти возбудители не только не отмирают, но, наоборот, продолжают размножаться при дополнительном инкубировании яиц при температуре 30 - 32° в течение 1 - 3 суток, в результате чего концентрация риккетсии за этот срок повышается в 10 100 раз.
Оптимальные условия для развития и максимального накопления риккетсий Бернета, Провачека и Музера создаются при использовании инфицирующей дозы, обеспечивающей на 8 - 9-й день после заражения гибель 50 - 70% куриных эмбрионов с применением для приготовления риккетсиосодержагцего материала как погибших в этот срок, так и оставшихся живых эмбрионов. Указанные условия обеспечивают получение из желточных оболочек культуры с концентрацией возбудителя группы сыпного тифа 106 - 108 ID50, а Ку-лихорадки - 109 - 1011 ID50 для морских свинок, что позволяет из этих культур готовить диагностические антигены и вакцины (Л. В. Васильева, 1948; П. Ф. Здродовский, 1948; Burnet и Freeman, 1937). Хотя концентрация риккетсий в желточных оболочках в 10 - 100 раз выше, чем в других тканях куриного эмбриона, однако для получения взвеси риккетсий целесообразно использовать не только желточные оболочки, но и прилежащий желток, который также содержит большое количество риккетсии.
Кроме выращивания в культурах клеток и куриных эмбрионах, для воспроизводства риккетсий использовали органы инфицированных лабораторных животных и переносчиков.
Еще в 1876 г. О. О. Мочутковский в опыте самозаражения установил возможность передачи возбудителя эпидемического сыпного тифа через вшей Pediculus vestimenti, a Nicolle в 1909 г. экспериментально обосновал механизм передачи эпидемического сыпного тифа. Da Rocha - Lima (1917) совместно с von Prowazek (1914), установив факт размножения риккетсий Провачека в желудке платяных вшей, напившихся крови больных сыпным тифом, впервые использовали зараженных вшей для изготовления сыпнотифозной вакцины.
Наблюдения da Rocha - Lima легли в основу исследований Weigl (1920), разработавшего оригинальную методику искусственного инфицирования вшей путем введения взвеси риккетсий в кишечник с помощью ректальных микроклизм. Кишечник зараженных вшей на высоте инфекции использовали для приготовления фенолизированной вакцины. Изготовленная по методу Вейгля вакцина до 1940 г. являлась единственным апробированным и более или менее широко применявшимся прививочным препаратом против сыпного тифа. Так, только в Польше указанной вакциной было привито около 1 млн. человек. Однако техника заражения вшей по методу Вейгля оставалась очень сложной и малопроизводительной, что резко повышало стоимость вакцины.
А. В. Пшеничнов с сотрудниками (1943, 1957), разработав для заражения вшей новый метод с применением эпидермомембран, упростили методику инфицирования вшей. Кроме того, предложенный способ оказался в 100 раз дешевле метода Вейгля. Применение для изготовления вакцины нимф, а не взрослых вшей, позволило добиться снижения ее реактивности, которой в значительной степени обладала вакцина из взрослых вшей. В последующем авторы еще больше упростили методику культивирования риккетсий Провачека путем выведения расы вшей, адаптированных к кроликам, что позволило отказаться от их кормления на донорах - людях (А. В. Пшеничнов, Е. Г. Носкова, 1957).
Имеющиеся в настоящее время методы заражения и кормления вшей с использованием эпидермомембран и вшей, адаптированных к кормлению на кроликах, позволяют успешно использовать их для культивирования риккетсий сыпного тифа и волынской лихорадки в лабораторных условиях. Однако трудности массового воспроизводства вшей в качестве продуцента риккетсий ограничивают сферу применения этого метода.
Определенным успехом в получении значительных количеств риккетсий Риккетса в свое время явилась разработанная Spencer и Parker методика выращивания возбудителя пятнистой лихорадки Скалистых гор в иксодовых клещах (Spencer и Parker, 1923, 1925, 1930). Из значительного количества видов клещей, оказавшихся способными инфицироваться риккетсиями Риккетса, наиболее подробному изучению подверглись клещи Dermacentor andersoni, которые были использованы для изготовления вакцины против пятнистой лихорадки Скалистых гор в США (Parker, 1929, 1935, 1941; Spencer и Parker, 1925). В Бразилии для изготовления аналогичной вакцины были использованы инфицированные риккетсиями Риккетса клещи Amblyomma cajennense (Dias и Martins, 1938; Travassos и Dias, 1939). В течение 30-х годов вакциной из инфицированных клещей было иммунизировано свыше 455 000 человек (Parker, 1941). Однако выращивание риккетсий Риккетса в иксодовых клещах оказалось весьма трудоемким и опасным для лабораторных работников, ввиду чего впоследствии вместо него стали применять культивирование в развивающихся куриных эмбрионах.
Несомненный теоретический интерес представляют наблюдения Weyer (1952, 1953, 1958) и ряда других исследователей относительно способности различных видов риккетсий размножаться в членистоногих, которые не являются естественными переносчиками риккетсиозов.
В результате исследований Durand и Sparrow (1940), Durand и Giroud (1941), а затем М. К. Кронтовской и Е. П. Савицкой (1942), М. М. Маевского (1943) и П. Ф. Здродовского (1948) была решена проблема культивирования риккетсий Провачека в легких белых мышей и кроликов и приготовления из них убитой сыпнотифозной вакцины, причем из легких одной мыши получалось до 20 - 25 млрд. риккетсий, что соответствует примерно 40 - 50 дозам вакцины, необходимым на полный курс прививок 10 - 15 человек. Использование для этих целей кроликов обеспечивает увеличение количества риккетсиозного материала примерно в 100 - 200 раз.
Для приготовления материала, содержащего возбудителя Ку-лихорадки, некоторые исследователи использовали селезенку белых мышей или плаценту абортировавших зараженных овец (Abinanti и соавторы, 1953; А. П. Зотов и соавторы, 1956, 1957; Н. И. Ходукин и соавторы, 1956, 1960). Несмотря на высокое накопление риккетсий в органах животных, эти культуры риккетсии представляют I фазу вариации, что ограничивает возможность их применения в качестве диагностического антигена.
Попытки приготовления вакцины против клещевых пятнистых лихорадок из крови и органов инфицированных животных не увенчались успехом из-за низкого содержания риккетсий (Conner, 1924; Spencer и Parker, 1930). Так, в соответствии с данными Price (1953) в 1 г ткани органов морских свинок, в которых отмечено наибольшее накопление риккетсий (селезенка и влагалищная оболочка яичка), концентрация риккетсий Риккетса не превышала 103,3-103,8 ID50.
В настоящее время выращивание риккетсий в желточных оболочках куриных эмбрионов находит все более широкое применение в лабораторной практике. Этот метод привлекает доступностью и возможностью получения больших количеств риккетсиозного материала для приготовления диагностических и вакцинных препаратов. Стерильность яичных культур в отличие от культур из переносчиков или органов животных (например, легочной ткани) позволяет широко использовать их при изготовлении живых риккетсиозных вакцин из штамма E риккетсий Провачека и варианта М-44 штамма Грита риккетсий Бернета.
Методика выращивания риккетсий в культурах тканей типа Карреля, Мейтландов и Цинссера, имевшая в свое время большое значение для изучения биологии возбудителей и приготовления чистой культуры риккетсий, из-за сложности и малой продуктивности оказалась непригодной для массового культивирования риккетсий.
Выращивание риккетсий на искусственных питательных средах представляет большой теоретический интерес, однако эта методика еще недостаточно изучена и в настоящее время не может быть применена для практических целей. Метод выращивания риккетсий в культуре перевиваемых или трипсинизированных клеток представляется весьма перспективным, однако он не вышел еще из рамок поисковых, теоретических работ и требует длительного изучения, прежде чем окажется приемлемым для выращивания риккетсий в объемах, необходимых для практических целей приготовления вакцины и диагностических антигенов.
Метод выращивания риккетсий в переносчиках и в организме животных имеет ряд недостатков, связанных с трудностями массового производства, нестерильностью членистоногих и опасностью работ.
Таким образом, в настоящее время наиболее приемлемым для культивирования риккетсий следует считать выращивание в куриных эмбрионах.
В отличие от вирусов, которые находят оптимум для развития в период активного метаболизма клеток, наиболее благоприятные условия для размножения риккетсий наступают при пониженном обмене веществ клеток (Bengtson, 1945; Greiff и Pinkerton, 1945; Wisseman и соавторы, 1951). Вследствие этого срок максимального накопления вирусов и риккетсий в тканевых культурах и куриных эмбрионах различен: для вирусов он равен 24 дням, а для риккетсий - 7 - 12 дням (Rivers, 1948; Л. А. Зильбер, 1956). Убедительной иллюстрацией роли понижения обмена веществ в клетках хозяина для культивирования риккетсий служат исследования Greiff и Pinkerton (1944, 1945, 1948, 1953, 1957), которые показали, что введение в эмбрион веществ, угнетающих метаболизм клеток (фтористый натрий в дозе 0,5 мг, цианистый калий в дозе 0,1 - 1 мг), или облучение куриных эмбрионов рентгеновыми, бета- и гамма-лучами (в дозах 250 - 1000 р) способствует увеличению концентрации риккетсий в желточных оболочках куриных эмбрионов. Фтористый натрий и цианистый калий известны как ингибиторы гликолиза из-за воздействия на фосфорилирование. Ионизирующее облучение, обладая антимитотическим эффектом, вызывает биохимические изменения в клетках, снижающие их метаболическую активность и повышающие содержание некоторых аминокислот и других соединений (бета-аланина, таурина, гамма-аминобутиловой кислоты, метилгистидина, цистина, этанол-амина и фосфорэтаноламина). Применявшиеся в опытах Greiff и Pinkerton дозы облучения оказывали действие исключительно на ткани куриного эмбриона и не влияли на риккетсии. То или иное действие облучения на возбудителя возможно при дозах, в 1000 - 10 000 раз больших, чем взятые в опыте (М. Н. Мейсель, 1955). Введение в эмбрион 0,5 мг фтористого натрия через 48 часов после заражения вызывает заметное увеличение накопления риккетсий при более ранней гибели куриных зародышей. Аналогичным действием обладают парааминобензойная кислота, рибофлавин, тиамин - хлорид, холин - хлорид и биотин. По данным Riley и соавторов (1964), введение в желточный мешок куриного эмбриона 0,1 у колхицина непосредственно перед заражением риккетсиями Бернета повышало накопление возбудителя на 100,8-102,3 ID50 в зависимости от величины инфицирующей дозы.
Повышение накопления различных риккетсии под влиянием ионизирующего облучения куриных эмбрионов наблюдали многие исследователи. Так, Bengtson в 1945 г. сообщила об успешном культивировании риккетсий Провачека в желточных мешках куриных эмбрионов, подвергнутых облучению 400 - 800 р. В этих опытах было отмечено заметное возрастание концентрации риккетсий. Greiff с сотрудниками (1953, 1957, 1960), детально изучив влияние рентгеновского и бета - излучения на накопление в куриных эмбрионах риккетсий Музера, установили, что максимальное повышение концентрации возбудителя достигается при облучении яиц дозой 500 р на 5-й день после заражения. Сходные результаты получены Kawamura и Shimizu (1955) при культивировании риккетсий лихорадки цуцугамуси.
Эти исследования объясняют причины неблагоприятного влияния повышенной температуры инкубирования зараженных куриных эмбрионов. Известно, что повышение температуры инкубирования до 40° вызывает резкое снижение накопления возбудителя, вероятно, вследствие активации окислительных процессов в клетках тканей. Угнетающее влияние высокой температуры на рост риккетсий удается исключить введением в куриный эмбрион фтористого натрия или цианистого калия (ингибиторов окисления).
Учитывая оптимум условий для размножения риккетсий в тканях с пониженным обменом веществ, определенный интерес представляет сообщение Karnofsky с соавторами (1951) об угнетающем действии кортизона на развитие куриного эмбриона, что могло послужить основанием для изучения возможности использования этого препарата для улучшения роста риккетсий. Angela и Di Nola (1957) сообщили об утяжелении инфекционного процесса при введении кортизона в 7-дневные куриные эмбрионы перед их заражением риккетсиями Бернета. Изучение влияния кортизона на рост риккетсий лихорадки цуцугамуси выявило различное действие этого препарата в зависимости от модели выращивания. Введение кортизона в куриные эмбрионы вызывает угнетение роста риккетсий, тогда как при введении препарата в организм животных, инфицированных этим возбудителем, происходит утяжеление инфекционного процесса (Нага и Aba, 1956). В. А. Гениг (1959) и Е. И. Шмелева (1961), показали возможность получения более выраженной картины сыпнотифозной лихорадки и обнаружения риккетсий Провачека и Музера в органах малочувствительных животных (кролики, белые мыши, белые крысы), подвергшихся действию кортизона.
В результате проведенных нами исследовании было установлено, что при введении в яйцо кортизона в дозах 0,5 - 4 мг гибель куриных эмбрионов, зараженных риккетсиями Провачека, задерживалась пропорционально дозе препарата от 1 - 2 до 4 - 5 дней, причем накопление риккетсий постоянно было в 100 - 1000 раз меньше, чем в эмбрионах, не обработанных кортизоном. Тем самым было показано, что кортизон хотя и замедляет развитие эмбриона и, бледовательно, угнетает метаболизм тканей, однако не способствует размножению риккетсий.
В отличие от ингибиторов метаболизма клеток хозяина, способствующих ускорению роста риккетсий, ингибиторы, действующие непосредственно на возбудителя, угнетают его размножение. Из практики клинического применения антибиотиков известна высокая терапевтическая эффективность при риккетсиозах антибиотиков тетрациклинового ряда (террамицина, тетрациклина и биомицина) и неэффективность пенициллина и стрептомицина. Эти данные подтверждены лабораторными исследованиями. Проведенные Greiff и Pinkerton (1948) и наши исследования позволили установить, что антибиотики, которые принято считать неэффективными при лечении риккетсиозов (пенициллин и стрептомицин), обладают выраженным риккетсиостатическим действием в опытах на куриных эмбрионах и культурах клеток (табл. 12). Однако в отличие от антибиотиков тетрациклинового ряда и эритромицина, весьма эффективных при риккетсиозах, пенициллин и стрептомицин оказывают четкое риккетсиостатическое действие только в десятки и даже сотни раз больших дозах. Это обстоятельство позволяет применять пенициллин и стрептомицин для подавления роста бактериальной флоры в обсемененных культурах риккетсий, но исключает применение их в клинической практике, ибо лечебные дозы совпадают с токсическими для организма. Так, например, для выделения возбудителей клещевых риккетсиозов из клещей или из каких - либо других объектов, содержащих постороннюю микробную флору, Parker с сотрудниками (1951) вводили в яйцо 100 ЕД пенициллина и 250 ЕД стрептомицина, a Price (1953) - 500 ЕД пенициллина и 250 ЕД стрептомицина.

Таблица 12. Действие некоторых антибиотиков на рост риккетсий в куриных эмбрионах
Ormsbee с соавторами (1955) показали высокое риккетсиостатическое действие террамицина (6 - 10 γ/эмбрион) значительно более низкое - хлорамфеникола (81 - 250 γ/эмбрион). Это, по-видимому, обусловлено различным действием антибиотиков на метаболизм риккетсий. Высокая окислительная способность тетрациклинов, выявленная Terada (1956) и другими исследователями, хорошо согласуется с выраженным антибиотическим действием их на риккетсии. Исследованиями А. Т. Кравченко, В. Н. Милютина и О. С. Гудимы (1963) было установлено, что при введении пенициллина и террамицина в культуру клеток HeLa, когда в ней четко прослеживается образование вакуолей с размножающимися риккетсиями Бернета, рост риккетсий угнетается, размеры колоний уменьшаются, а движение риккетсиозных частиц прекращается. После удаления антибиотиков из культуральной среды заменой питательной смеси риккетсии вновь приобретают подвижность, размеры колоний увеличиваются, а количество риккетсий в них возрастает. Эти исследования показали, что антибиотики действуют на возбудителя Ку-лихорадки не как риккетсиоцидные вещества, а как ингибиторы роста и обмена. Был также показан различный характер действия террамицина и пенициллина. Если пенициллин приводит к резким изменениям размеров и формы риккетсий (L-трансформация), то террамицин не вызывает у риккетсии микроскопически видимых морфологических изменений. Можно предположить, что пенициллин и террамицин оказывают действие на различные биохимические системы риккетсий, что достаточно четко было показано М. Н. Лебедевой, С. Д. Воропаевой (1960) и Ю. О. Сазыкиным (1961).
Действие антибиотиков на размножение риккетсий существенно отличается от их действий на бактерии и вирусы. В отличие от бактерий, антибиотики не влияют на последующий рост риккетсий при обработке их in vitro, так как действие препарата определяется дозой, а не временем экспозиции до заражения. На размножение вирусов антибиотики, угнетающие рост риккетсий и бактерий, не оказывают действия, что объясняется своеобразием репродукции вирусов и отсутствием у них автономного метаболизма или иным его характером.
Причины различных требований вирусов и риккетсий к условиям выращивания заключаются в природе этих возбудителей и особенностях их репродукции. Как уже отмечалось, репродукция вируса зависит от скорости редупликации вирусной нуклеиновой кислоты в клетке хозяина. Чем быстрее и энергичнее протекают процессы жизнедеятельности в клетке, тем больше синтез нуклеиновых кислот и количество образовавшихся вирусных частиц, поэтому угнетение клеточного обмена ингибиторами метаболизма приводит к уменьшению выхода вируса. Иная картина наблюдается при размножении риккетсий. В этом случае происходит не только редупликация нуклеиновых кислот, но и синтез других составных элементов риккетсиозной клетки. В данном процессе большую роль играют энзимные системы самих риккетсий, активно участвующие в синтезе необходимых для построения риккетсий компонентов с использованием некоторых пластических веществ клетки хозяина. Это, во-первых, определяет сравнительно меньшую скорость воспроизведения у риккетсий, чем у вирусов, и, во-вторых, в значительной степени объясняет причину лучшего размножения риккетсий при пониженном уровне метаболизма клеток, что позволяет риккетсиям усваивать субпродукты обменных реакций клетки - хозяина. Пониженный метаболизм в клетках приводит к меньшему расходу пластического материала самими клетками, который активно усваивается риккетсиями.
Таковы, вероятно, принципиальные отличия условий репродукции вирусов и риккетсий, зависящие от различной биологической природы этих возбудителей.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'