
Глава 8. Изменчивость и наследственность у риккетсий Бернета
Ряд наблюдений свидетельствует об изменении биологических свойств риккетсий Бернета в зависимости от условий внешней среды. Так, выделенный в Монпелье штамм вызывал на 20 - 30-й день после тестикулярного заражения гибель 40% морских свинок. После нескольких пассажей на морских свинках вирулентность штамма повысилась и он стал вызывать гибель всех животных на 5 - 10-й день после заражения с явлениями энцефалита и в ряде случаев кератита. Этот вариант риккетсий имел ту же антигенную структуру и морфологию, что и исходный штамм, однако утратил способность размножаться в куриных эмбрионах. Тот же штамм повысил вирулентность для морских свинок после пассажа через овцу. Так, например, кровь инфицированной овцы вызывала развитие смертельного заболевания у всех морских свинок (Carrere, Roux, 1954; Саггёге с соавторами, 1956; Roux, 1956).
Н. И. Амосенковой, А. Б. Дайтером, Л. Д. Васильевой, К. Н. Кленовым в 1955 - 1959 гг. в Ленинградской области и Ленинграде было выделено 12 штаммов риккетсий Бернета. Для испытания вирулентности этих штаммов авторы использовали культуры, прошедшие не более 5 пассажей в куриных эмбрионах при введении в полость желточного мешка разведений суспензии 10-3-10-5 в объеме 0,2 мл.
Brezina с сотрудниками (1963) в Чехословакии выделили от больных людей, зараженных животных и клещей группу штаммов риккетсий Бернета и провели сравнительное изучение их свойств.
Наблюдения советских и чехословацких исследователей свидетельствуют о значительном варьировании вирулентности различных штаммов риккетсий Бернета, причем 1 летальная доза для морских свинок варьирует от 105 до 1012 ID50. Кроме того, Н. И. Амосенкова и Л. Д. Васильева (1961) отметили, что штамм Желтогорлая мышь - Луга вызывает у морских свинок образование комплементсвязывающих антител в титре 1:10-1:640 при введении культуры из желточных мешков куриных эмбрионов даже в разведении 10-13-10-14.
Таким образом, в естественных условиях удалось обнаружить штаммы риккетсий Бернета с различной вирулентностью, причем штаммы с низкой вирулентностью приближаются к вакцинным (например, Z - 57 и Ленинград - 2). Наиболее вирулентными оказались штаммы, выделенные от членистоногих и диких животных. Штаммы риккетсий Бернета, выделенные от больных людей и сельскохозяйственных животных, были маловирулейтными.
В лабораторных условиях неоднократно отмечалось снижение вирулентности риккетсий Бернета. Так, еще в 1941 г. Сох отметил снижение вирулентности для морских свинок австралийского и американского штаммов риккетсий Бернета при длительном выращивании в желточных оболочках развивающихся куриных эмбрионов.
В 1957 г. В. А. Гениг под руководством П. Ф. Здродовского при обследовании яичной культуры 44-го пассажа штамма Брита, полученной в 1954 г., выявила малопатогенный вариант риккетсий Бернета (П. Ф. Здродовский, 1959; В. А. Гениг, 1960, 1963). Проведенное В. А. Гениг (1960, 1963) изучение свойств данного варианта, обозначенного первоначально как вариант М, а затем описанного как 44-М и М-44, показало, что он, не отличаясь по морфологии и накоплению в желточных оболочках куриных эмбрионов от вирулентного штамма Брита, обладал гораздо меньшей патогенностью для морских свинок при внутрибрюшинном, подкожном, тестикулярном, внутрикожном и накожном способах заражения. Так, при подкожном введении варианта М-44 клинические симптомы инфекции у морских свинок отмечались только в случае инъекции в 105-106 раз больших доз, чем штамма Брита, причем заболевание протекало гораздо доброкачественнее. Местная реакция у морских свинок развивалась только после введения больших количеств варианта М-44. Накопление риккетсий варианта М-44 в инфильтрате и в регионарных лимфатических узлах было гораздо меньше, чем у животных, инфицированных штаммом Брита.
Помимо морских свинок, вариант М-44 оказался менее патогенным, чем штамм Брита, также для белых мышей и кроликов.
Наряду с отчетливым снижением патогенности для лабораторных животных вариант М-44, даже при однократной инъекции высоких разведений яичной культуры (до 10-8), обеспечивал появление в сыворотке морских свинок специфических комплементсвязывающих антител, хотя и в более низких титрах, чем вирулентный штамм Брита. Уже через 3 - 7 дней после инъекции варианта М-44 морские свинки оказывались резистентными к 103 инфицирующих доз вирулентной культуры риккетсий Бернета. На 45 - 50-й день морские свинки были невосприимчивы к 105 инфицирующих доз риккетсий Бернета, причем иммунитет сохранялся не менее года.
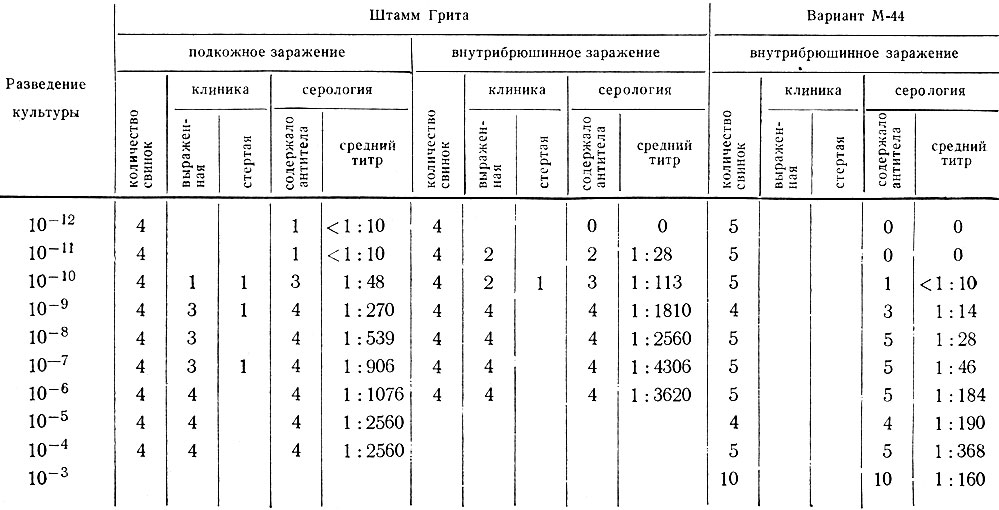
Таблица 13. Восприимчивость морских свинок к эталонному штамму Грита риккетсий Бернета и его варианту М-44
Примечание. Титр комплементсвязывающих антител к антигену II фазы определен на 25-й день, после заражения.
Наши исследования (А. И. Полозов и В. Н. Паутов, 1961) подтвердили наблюдения П. Ф. Здродовского и В. А. Гениг о стойком снижении патогенности варианта М-44. Так, у морских свинок после внутрибрюшинного, внутримышечного и внутрикожного заражения лихорадочная реакция отмечалась лишь в случае инъекции больших доз риккетсий, причем местная реакция при внутрикожном заражении была менее выраженной. Титры комплементсвязывающих антител (к антигену II фазы) в сыворотке морских свинок после введения даже больших доз варианта М-44 (порядка 106-107 ID50) не превышали 1:320-1:640, тогда как у животных, зараженных оригинальным штаммом Трита, титр антител достигал 1:1280-1:2560 и выше (табл. 13).
Таким образом, изучение свойств варианта М-44 показало его низкую вирулентность для морских свинок и достаточно выраженную иммуногенность, близкую к исходному штамму Трита (табл. 14).
В соответствии с нашими наблюдениями энтеральное введение морским свинкам варианта М-44 не вызывает клинически выраженного заболевания, но обеспечивает появление в сыворотке комплементсвязывающих антител и приобретение животными резистентности к вирулентной культуре риккетсий Бернета. Доза риккетсий, обеспечивающая иммунизацию 50% морских свинок при энтеральном введении варианта М-44, оказалась равной примерно 60 ID50 для белых крыс (А. А. Воробьев и В. Н. Паутов, 1964).
Исследования А. Т. Кравченко с соавторами (1963) также свидетельствуют о значительном снижении патогенности указанного варианта риккетсий Бернета, обозначенного авторами как Грита - Д. Так, у морских свинок лихорадочная реакция до 39,6 - 39,8° в течение 2 - 3 дней наблюдалась только после инъекции больших доз риккетсий.

Таблица 14. Сравнительная оценка вирулентности штамма Грита риккетсий Бернета и его варианта М-44 для морских свинок
Условные обозначения: FD50, ID50 и DD50 - содержание в 1 мл культуры доз, обеспечивающх соответственно лихорадочное заболевание, образование антител и кожную реакцию у 50% морских свинок.
В связи с отчетливым снижением патогенности у варианта М-44 риккетсий Бернета большое значение приобрело изучение стабильности его свойств. Оказалось, что при последовательных пассажах на морских свинках происходит истощение культуры, ввиду чего не удается провести более 7 - 8 перевивок. Снижение естественной резистентности морских свинок с помощью кортизона не отразилось на доброкачественности течения экспериментального риккетсиоза, вызванного вариантом М-44 (В. А. Гениг, 1963). Вирулентность варианта М-44 не изменилась при длительном выращивании риккетсий в среде с переживающими тканями (Н. Н. Рыбкина, 1960), после 5 пассажей через яичко морских свинок (А. Т. Кравченко с соавторами, 1963) и при пассажах на иксодовых клещах (А. И. Полозов, В. Н. Паутов, 1961; А. Т. Кравченко с соавторами, 1963).
По данным В. А. Гениг (1963), в лиофильно высушенной яичной культуре свойства варианта М-44 не изменяются по крайней мере в течение 3 лет (срок наблюдения).
Учитывая наши результаты 10 - летнего наблюдения за сохранением лиофильно высушенных яичных культур штамма Грита (В. Н. Паутов, А. И. Полозов, 1961), можно полагать, что высушенные культуры варианта М-44 останутся стабильными в течение весьма длительного срока.
Полученные данные, свидетельствующие о стойком снижении патогенности варианта М-44 риккетсий Бернета для лабораторных животных, позволили испытать этот вариант в качестве живой вакцины для иммунизации людей. Впервые вакцинация людей вариантом М-44 была осуществлена в 1961 г. П. Ф. Здродовским й В. А. Гениг (П. Ф. Здродовский, В. А. Гениг, 1962; В. А. Гениг, 1963).
По данным В. А. Гениг (1963), после подкожной инъекции 105 инфицирующих доз (для куриных эмбрионов) варианта М-44 из 28 вакцинированных человек у 17 общей реакции не наблюдалось, у 9 отмечалось лишь кратковременное повышение температуры до 37,2 - 37,5° и только у 2 человек температура достигала 37,6 - 38,5°. Местная реакция наблюдалась у 8 человек, причем у семи отмечался инфильтрат менее 3 см, а у одного - инфильтрат до 6 см. В случае инъекции варианта М-44 в количестве 103 - 104 инфицирующих доз (для куриных эмбрионов) из 20 иммунизированных человек слабая общая реакция (повышение температуры до 37,2 - 37,5°) наблюдалась у 5 человек, а слабая местная реакция - у четырех. Общая реакция отмечалась на 2 - 3-и сутки и, кроме повышения температуры, характеризовалась кратковременным ознобом, иногда недомоганием и головной болью. Сильных ранних реакций, а также поздних отдаленных реакций не наблюдалось. Местная реакция развивалась на 3 - 4-е сутки и продолжалась в среднем в течение 48 часов. В период с 6-го по 17-й день после введения варианта М-44 в крови 16 обследованных человек риккетсии не были обнаружены. В крови всех иммунизированных спустя 21 - 30 дней были выявлены специфические комплементсвязывающие антитела, титр которых достиг максимума на 60 - 75-й день (средний титр 1:84). Спустя 1 год антитела были обнаружены в сыворотке 7 из 8 обследованных.
После ревакцинации вариантом М-44 у лиц, имевших в сыворотке специфические антитела и работавших в очаге Ку-лихорадки, наблюдалась местная реакция с максимумом на 3 - 4-й день. У лиц, которые работали в очаге Ку-лихорадки, но в сыворотке которых антитела отсутствовали, на 2-е сутки было зарегистрировано однодневное повышение температуры до 37,5 - 38,8°, которое сопровождалось местной реакцией, головной болью и кратковременным ознобом.
В случае ревакцинации вариантом М-44 сотрудников риккетсиозной лаборатории через 4 года после иммунизации убитой корпускулярной вакциной при инъекции около 103 инфицирующих доз (для куриных эмбрионов) лихорадочная реакция в большинстве случаев отсутствовала, однако в течение 2 дней отмечались озноб, разбитость и головная боль. После инъекции меньших доз риккетсий общая реакция отсутствовала, однако на 5 - 7-й день наблюдалась местная реакция в виде слабой гиперемии и припухлости. По мнению В. А. Гениг, эти реакции скорее всего обусловлены специфической сенсибилизацией людей при длительном соприкосновении с возбудителем Кулихорадки.
После апробации варианта М-44 в июле 1961 г. Комитет вакцин и сывороток Министерства здравоохранения СССР рекомендовал указанный вариант риккетсий Бернета в качестве живой вакцины против Ку-лихорадки.
В соответствии со сводными данными П. Ф. Здродовского (1963) по иммунизации 1040 человек при подкожной инъекции 0,5 мл разведения 10-4 яичной культуры риккетсий с активностью 108 - 109 инфицирующих доз (для куриных эмбрионов) реакция наблюдалась у 4,8%. Спустя месяц комплементсвязывающие антитела были обнаружены в сыворотке 93% иммунизированных, а спустя 5 - 6 месяцев - у 78% обследованных людей.
Таким образом, полученные к настоящему времени данные свидетельствуют о возможности стойкого, резко выраженного и наследственно закрепленного снижения вирулентности риккетсий Бернета при длительном культивировании в развивающихся куриных эмбрионах.
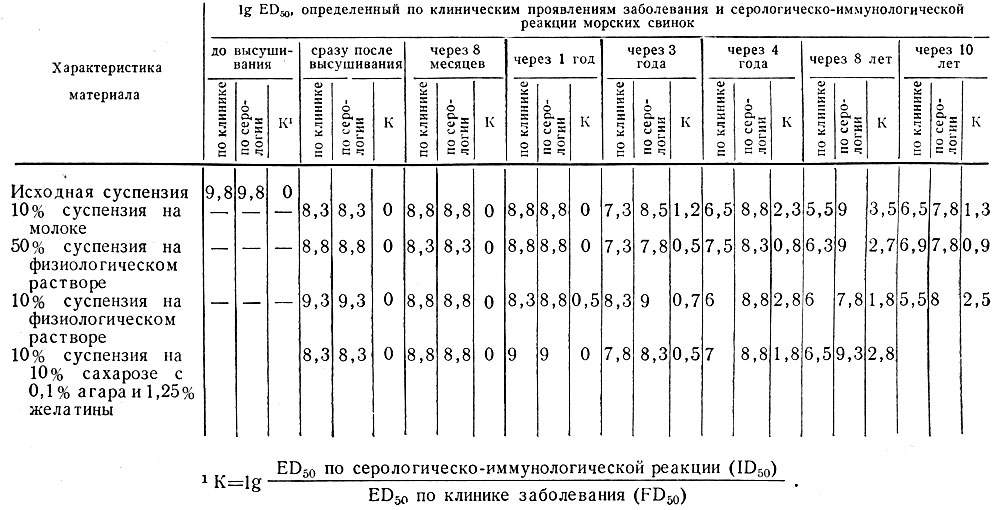
Таблица 15. Концентрация и вирулентность риккетсий Бернета в лиофильно высушенных препаратах, хранящихся при 4° под вакуумом
С целью изучения влияния хранения на свойства риккетсий Бернета мы оценивали вирулентность штамма Грита в культурах, длительно находившихся в различных условиях (А. И. Полозов и В. Н. Паутов, 1961; В. Н. Паутов и А. И. Полозов, 1961). Вирулентность контролировали на морских свинках по двум показателям: по способности вызывать, клинически выраженную форму Ку-лихорадки при введении в брюшную полость различных доз риккетсий (FD50) и по результатам реакции связывания комплемента и наличию иммунитета к повторному заражению вирулентной культурой (серологическо-иммунологический показатель ID50). Было изучено 16 серий яичных культур риккетсий Бернета, высушенных под вакуумом из замороженного состояния и хранившихся под вакуумом при 4°. Оказалось, что свежеприготовленные культуры и препараты, хранившиеся в течение года, как правило, не вызывали у морских свинок бессимптомных форм инфекции даже при введении минимальных доз риккетсий. В результате значения, определенные на основании клинических проявлений Ку-лихорадки (FD50) и серологической и иммунологической реакций животного (ID50), полностью совпадали, т. е. активность культур, выраженная в FD50, FD50 равнялась показателям, выраженным в ID50, а
| lg= | ID50 | равнялся 0. |
| FD50 |
Однако, уже после трехлетнего хранения введение небольших доз препаратов не вызывало у морских свинок отчетливых клинических симптомов заболевания, но обеспечивало образование комплементсвязывающих антител (к антигену II фазы риккетсий) и приобретение животными иммунитета к 105-106 ED50 вирулентной культуры риккетсий Бернета. Спустя 4 - 10 лет хранения при 4° во всех сериях препаратов было обнаружено четко выраженное снижение вирулентности риккетсий. В итоге значения lg ED50, рассчитанные на основании серологическо - иммунологических показателей у животных (ID50), закономерно оказывались выше значения lg ED50, определенных по клиническим проявлениям заболевания (FD50). В качестве примера в табл. 15 приведены результаты одного из опытов по изучению концентрации и вирулентности риккетсий Бернета в сухих культурах, находившихся под вакуумом при 4°.
При хранении сухих культур риккетсий Бернета без вакуума снижение вирулентности выражается более отчетливо (табл. 16). Так, после 4 - 5-летнего хранения препаратов различие в значениях ED50, рассчитанных по серологическо - иммунологическому показателю (ID50) и по клиническим проявлениям заболевания (FD50), превышало 1000 - 10 000 раз, ввиду чего препараты не вызывали у морских свинок клинических симптомов риккетсиоза при внутрибрюшинном введении даже 103-104 доз, обусловливающих образование антител и приобретение морскими свинками иммунитета к вирулентной культуре риккетсий Бернета.

Таблица 16. Активность для морских свинок сухой культуры риккетсий Бернета, хранившейся при 4° без вакуума
Для изучения характера изменения вирулентности риккетсий Бернета при длительном хранении были проведены пассажи культур на куриных эмбрионах, зараженных дозой, не вызывающей клинических симптомов инфекции у морских свинок. Оказалось, что после 1 - 2 пассажей на куриных эмбрионах риккетсии восстанавливали высокую вирулентность и вновь вызывали у морских свинок, как правило, заболевание, протекающее с отчетливой клинической картиной.
Аналогичные изменения свойств риккетсий Бернета были обнаружены после хранения в течение 2 - 3 лет при 4° невскрытых инфицированных яиц, суспензии из яиц, а также органов больных морских свинок в глицерине. Однако при хранении сухой яичной культуры без вакуума при 20° не отмечалось различий в значениях ED50, установленных по клинической картине заболевания (FD50) и по серологическо - иммунологической реакции морских свинок (ID50).
Н. Н. Ураков (1962) отметил снижение вирулентности риккетсий Бернета при облучении культуры вирулентного штамма Брита β- лучами в сочетании с 27 субпассажами на куриных эмбрионах, однако это свойство оказалось нестабильным.
Своеобразной формой изменчивости риккетсий Бернета является так называемая фазовая вариация. Впервые с феноменом фазовой вариации исследователи столкнулись вскоре после начала сравнительного изучения различных штаммов риккетсий Бернета. Еще в 1946 г. Topping с соавторами, Robbins с соавторами, а в 1949 г. E. и A. Rodaniche пришли к заключению о более высокой антигенной активности в реакции связывания комплемента итальянских и австралийских штаммов риккетсий Бернета, чем американских штаммов. Так, в сыворотке инфицированных морских свинок и переболевших людей комплементсвязывающие антитела в присутствии антигена из итальянского штамма Henzerling удавалось обнаружить уже в ранние сроки, тогда как в присутствии антигена из американского штамма Dyer антитела у морских свинок выявлялись лишь на 40 - 70-й день, а в сыворотке людей антитела вообще не обнаруживались. На основании такого рода наблюдений было высказано предположение о наличии у риккетсий Бернета двух отличающихся антигенов. Штаммы риккетсий, антигены из которых хорошо реагировали в реакции связывания комплемента, были объединены в группу высокоактивных (например, штамм Henzerling), а другие - в группу малоактивных (например, штамм Dyer). Однако исследования Wolfe и Kornfeld (1949) не выявили антигенных различий между американским штаммом Nine Mile и итальянским штаммом Henzerling. Более того, по данным Strauss и Sulkin (1949), американские штаммы Nine Mile и Dyer существенно отличаются друг от друга по активности в реакции связывания комплемента, причем штамм Nine Mile близок к итальянским штаммам, от которых значительно отличается штамм Dyer. Между тем штамм Dyer был выделен от человека, заразившегося в лабораторных условиях именно при работе со штаммом Nine Mile. Таким образом, оставалось предположить, что однократный пассаж штамма Nine Mile через человека значительно изменил антигенную структуру риккетсий.
Различия в активности в реакции связывания комплемента антигенов из различных штаммов риккетсий Бернета были обнаружены и другими исследователями (Herzberg и Urbach, 1951; Berge и Lennette, 1953; Snyder с соавторами, 1947; Smadel с соавторами, 1948, и др.).
Указанные наблюдения позволили Stoker (1950, 1953, 1954) предполжить, что различия антигенной активности штаммов риккетсий Бернета обусловлены не природными особенностями самих штаммов, а свойствами культур риккетсий, использованных для изготовления антигенов. Эта гипотеза была успешно подтверждена Stoker в серии исследований. Так, например, оказалось, что антигены английских штаммов Christie и М-1, приготовленные из культур риккетсий, прошедших небольшое количество пассажей на куриных эмбрионах, не обнаруживают комплементсвязывающие антитела в сыворотках раннего периода реконвалесценции и выявляют их в низком титре в сыворотках позднего периода реконвалесценции. Аналогичные антигены из культур риккетсий, прошедших большое количество пассажей на куриных эмбрионах, выявляют в высоком титре комплементсвязывающие антитела в сыворотках как позднего, так и раннего периода реконвалесценции. Таким образом, антигены из культур первых яичных пассажей оказались подобны антигенам из штаммов "малоактивной группы", тогда как антигены тех же штаммов, но проведенных многократно через куриные эмбрионы оказались аналогичными антигенам "высокоактивной группы".
Выявленное Stoker изменение антигенной активности риккетсий Бернета при культивировании в куриных эмбрионах впоследствии было обнаружено и у других штаммов. Так, Stoker и Fiset (1956) отметили данный феномен у американского штамма Nine Mile, Moreli и Gerbec (1956, 1959) - у нескольких югославских штаммов, в частности у штаммов Pirot и В. В., а также у американского штамма Dyer, Brezina (1958) - у чехословацких штаммов Strobová, Florián, Ixodes ricinus и L35, FI. И. Федорова и Р. Г. Дюйсалиева (1962) - у отечественного штамма Шоршер, Н. И. Амосенкова и Л. Д. Васильева (1961) - у отечественных штаммов Термез, Кучмай и Желтогорлая мышь - Луга и у итало-греческого штамма Грита, А. И. Яковлев и А. И. Полозов (1962) - у румынского штамма Констанца и итало-греческого штамма Грита, Anacker с соавторами (1962) - у американского штамма Ohio, Mikolajczyk (1963) - у штамма Henzerling, африканского штамма Bangui и польского штамма 755.
По предложению Stoker и Fiset (1956), изменение антигенной активности риккетсий Бернета в реакции связывания комплемента было названо фазовой вариацией. Культуры риккетсий, антиген из которых не выявлял антитела в антисыворотках раннего периода реконвалесценции, но обнаруживал их в более поздних сыворотках, получили название I фазы, а культуры риккетсий, антиген из которых выявлял антитела в сыворотках как позднего, так и раннего периодов реконвалесценции, были названы II фазой. А так как переход риккетсий из I фазы во II фазу происходит постепенно, то для культур риккетсий, уже обладающих свойствами II фазы, но еще не стабилизировавшихся в этом состоянии, было рекомендовано название "переходная фаза" (А. И. Яковлев и А. И. Полозов, 1962).
В настоящее время нет единой системы обозначения фаз риккетсий Бернета и соответствующих антигенов. Bobb и Downs (1962) рекомендуют обозначать фазы риккетсий арабскими цифрами, а антигены - римскими цифрами, однако эта система не является общепринятой.
В естественных условиях (в иксодовых клещах, селезенке овец, молоке коров и др.), а также в организме экспериментально инфицированных животных (морские свинки, белые мыши, овцы, хомячки и др.) риккетсии Бернета находятся в I фазе (Stoker и Fiset, 1956; Н. И. Амосенкова и Л. Д. Васильева, 1961; А. И. Яковлев и А. И. Полозов, 1962; Brezina и Urvolgyi, 1961, и др.). Риккетсии переходят из I фазы во II фазу, как впервые было отмечено Stoker (1950, 1953), при пассажах на куриных эмбрионах, однако фазовое состояние у отдельных штаммов изменяется с различной быстротой. Так, штамм Christie стабилизировался во II фазе к 9-му пассажу (Stoker, 1953), штамм Nine Mile - после 8 пассажей (Stoker и Fiset, 1956), штаммы L35, Strobova, Florian и Ixodes ricinus - после 10 - 13 пассажей (Brezina, 1958, 1959) штамм Констанца - к 12-му пассажу (А. И. Яковлев и А. И. Полозов, 1962), штаммы Кучмай, Термез, Трита и Желтогорлая мышь - Луга - после 10 - 15 пассажей (Н. И. Амосенкова и Л. Д. Васильева, 1961), штаммы Schwaben I и II и Heidelberg - после 14 - 16 пассажей (Herzberg и Urbach, 1951). Однако в опытах Berge (цит. по Fiset, 1959) один из штаммов остался в I фазе после 68 пассажей в куриных эмбрионах. В исследованиях Anacker с соавторами (1962) штамм Ohio после 16 пассажей на куриных эмбрионах находился в I фазе. По данным Ormsbee с соавторами (1964), штамм Ohio - 314 содержал большое количество риккетсий I фазы даже после 22 пассажей на куриных эбрионах. По мнению Stoker и Fiset (1956) и Ormsbee с соавторами (1964), на быстроте перехода риккетсий Бернета из I фазы во II фазу сказываются не только особенности штаммов, но и методика пассажей, в частности степень разведения культуры риккетсий и время вскрытия инфицированных куриных эмбрионов.
В опытах Stoker и Fiset (1956) обратный переход риккетсий из II фазы в I фазу (штамм Nine Mile и Christie) был зарегистрирован после 2 - 3 пассажей на морских свинках, при 15 - дневном пребывании в организме морских свинок или 30-дневном - в белых мышах. Переход II фазы штамма Констанца в I фазу в опытах А. И. Яковлева и А. И. Полозова (1962) начался после I пассажа на морских свинках и завершился после 4 пассажей; штамм Грита, находившийся в переходной фазе, приобрел качества I фазы после 15 - дневного выживания в организме овцы. По данным Brezina и Urvolgyi (1961), штаммы Florian, Ixodes ricinus и L35 перешли из II фазы в I фазу после 3 - 4 пассажей на белых мышах. Переход из II фазы в I фазу при пассажах на морских свинках был отмечен также у штаммов Pirot (Morelj и Gerbec, 1956, 1959), Грита, Термез, Кучмай и Желтогорлая мышь - Луга (Н. И. Амосенкова и Л. Д. Васильева, У v? 1961). Brezina и Rehacek (1961) наблюдали превращение II фазы штамма Henzerling в I фазу при выращивании в клещах D. marginatus. Однако в исследованиях А. И. Яковлева и А. И. Полозова (1962) после пребывания в течение 30 дней в клещах R. sanguineus антигенная структура II фазы штамма Констанца не изменилась и риккетсии не приобрели свойств I фазы. Наконец, как свидетельствуют наблюдения Carvalho de Souza (1959), II фаза штамма Nine Mile превращается в I фазу при выращивании в первично трипсинизированных клетках куриных и мышиных эмбрионов в присутствии специфической антисыворотки к антигену II фазы риккетсий. Однако в исследованиях О. С. Гудимы (1960) риккетсии, находившиеся во II фазе (штамм Грита), приобрели свойства I фазы при выращивании в культуре клеток HeLa без специфической антисыворотки.
Превращение риккетсий Бернета из I фазы во II фазу при культивировании в куриных эмбрионах Fiset (1955, 1959), а также и некоторые другие исследователи (Carvalho de Souza, 1959; А. И. Яковлев и А. И. Полозов, 1962) связывают с неспособностью эмбрионов вырабатывать специфические антитела. Напротив, в организме животных в результате воздействия антител риккетсии Бернета приобретают структуру I фазы (Stoker и Fiset, 1956). В пользу такого предположения свидетельствуют данные Fiset (1955, 1959) о том, что штамм Nine Mile при выращивании в куриных эмбрионах в присутствии антисыворотки к антигену II фазы оставался в I фазе. По мнению А. И. Яковлева и А. И. Полозова (1962), отмеченное в их опытах сохранение риккетсии в виде II фазы при выращивании в клещах также может быть объяснено неспособностью членистоногих образовывать антитела. В противоположность этим исследованиям Brezina и Rehacek (1961) отметили превращение II фазы в I фазу при выращивании в клещах. Данное наблюдение позволило авторам предположить, что антитела не являются единственным фактором, ответственным за возникновение и сохранение I фазы риккетсий Бернета. Об этом же свидетельствуют и данные О. С. Гудимы, наблюдавшего переход риккетсий из II фазы в I фазу в культуре ткани при отсутствии в ней специфических антител.
Изучение динамики накопления комплементевязывающих антител в сыворотке морских свинок показало, что антитела ко II фазе риккетсий появляются в первые дни после перенесения Ку-лихорадки, достигают максимума к 20 - 30-му дню, а затем длительно обнаруживаются в снижающемся титре. Антитела к I фазе риккетсий образуются лишь к 30 - 40-му дню и достигают максимума к 45 - 95-му дню (Stoker и Fiset, 1956; А. И. Яковлев и А. И. Полозов, 1962). По данным Sidwell и Gebhardt (1962), в сыворотке диких грызунов в первые 3 недели после заражения в высоком титре содержатся антитела к антигену II фазы, на 4 - 7-й неделе - в относительно невысоком титре к I фазе и в высоком титре ко II фазе. Спустя 10 - 18 недель в относительно невысоком титре обнаруживаются антитела к I и II фазам, а через 25 - 36 недель - только ко II фазе.
В соответствии с наблюдениями Stoker (1953) антигены из I фазы штамма Christie и из II фазы штамма Henzerling не отличаются по активности в реакции агглютинации. А. И. Яковлев и А. И. Полозов (1962) также не обнаружили различии в агглютинабельности антигенов из I и II фаз риккетсий (штаммы Грита и Констанца). С другой стороны, рядом исследователей были отмечены определенные различия в агглютинабельности отдельных штаммов, однако эти свойства штаммов не оценивались с учетом фазового состояния риккетсий (Topping с соавторами, 1946; Herzberg и Urbach, 1951; Herzberg и May, 1955, и др.). Наконец, Brezina и Urvolgyi (1961) показали, что феномен фазовой изменчивости наблюдается и в реакции агглютинации штаммов Henzerling, Florian, Ixodes ricinus и L35. Штамм Nine Mile оказался совершенно неагглютинабельным, причем это качество не зависело от фазового состояния. Данное обстоятельство позволило Brezina и Urvolgyi предположить влияние на агглютинабельность штаммов риккетсий Бернета как фазового состояния, так и каких-то иных факторов. Кроме того, было отмечено, что реакция агглютинации с I фазой риккетсий протекает быстро, ввиду чего результаты можно учитывать уже через 2 - 3 часа, причем сама реакция характеризуется образованием крупных хлопьев. Агглютинация II фазы риккетсий протекает медленнее, а результаты можно учитывать только через 16 - 18 часов, причем в данном случае образуются зернистые агломераты.
В соответствии с наблюдениями Р. Г. Дюйсалиевой и Н. И. Федоровой (1964) фазовая изменчивость риккетсий Бернета выявляется не только в реакции связывания комплемента, но и в реакции агглютинации, причем с антигеном из I фазы риккетсий образуется крупнохлопчатый, а с антигеном из II фазы - мелкозернистый агломерат. В сыворотке морских свинок, зараженных риккетсиями I фазы, динамика агглютининов и комплементсвязывающих антител не совпадала, но у животных, зараженных культурой риккетсий II фазы, динамика комплементсвязывающих и агглютинирующих антител в отношении антигена II фазы совпадала.
Ormsbee с соавторами (1964) также отмечают, что фазовое состояние риккетсий, использованных в качестве антигена, имеет большое значение при проведении реакции агглютинации.
Исследования Brezina и Kazár (1963, 1965) показали, что специфический фагоцитоз I фазы риккетсий увеличивается только в присутствии антисыворотки, содержащей антитела против антигена I фазы. В присутствии антисыворотки, содержащей антитела лишь против антигена II фазы, наблюдалось увеличение фагоцитоза только II фазы риккетсий. Таким образом, в специфическом фагоцитозе риккетсий Бернета участвуют по крайней мере два типа опсонинов, соответствующих двум антигенным компонентам риккетсий. Кроме того, оказалось, что I фаза риккетсий фагоцитируется в отсутствие специфической' антисыворотки значительно хуже, чем II фаза.
Исследования Ormsbee (1961) выявили качественные физические различия между I и II фазой риккетсий Бернета при их очистке. В дальнейшем исследования Hoyer, Ormsbee, Fiset и Lackman (1963) показали наличие у I и II фаз различной плотности (у I фазы 1,33, у II фазы 1,21), что позволило разделить эти фазы осаждением в градиенте плотности хлористого цезия по методике, рекомендованной Meselson, Stahl и Vinograd (1957). При центрифугировании в течение 16 часов при 35 000 об/мин (свыше 100 000 g) риккетсии I фазы образовывали гомогенный слой в зоне плотности 1,33, тогда как при центрифугировании II фазы слой риккетсий располагался в зоне плотности 1,21. В случае центрифугирования смеси риккетсий I и II фаз образовывались два слоя, характерные для обеих фаз. Таким образом, осаждение в градиенте плотности позволяет разделять I и II фазы риккетсий как из искусственной смеси, так и из культуры переходной фазы. Кроме того, данная методика позволяет точно оценивать однородность популяции риккетсий, что особенно важно при дифференциации переходной и II фазы возбудителя.
Kordovà и Brezina (1963) разницы в размножении в тканевых культурах I и II дозы риккетсий не нашли.
Stoker и Marmion (1955) и Fiset (1955, 1957) предположили наличие у I фазового варианта риккетсий двух антигенов, один из которых расположен на поверхности риккетсий (антиген I фазы), а другой - более глубоко (антиген II фазы). При наличии поверхностного антигена I фазы глубинный антиген II фазы не может вступить в реакцию со специфическими к нему антителами, поэтому для выявления антигена I фазы необходимо использовать сыворотки позднего периода реконвалесценции, которые содержат соответствующие антитела. Данное обстоятельство было впервые использовано Abinanti и Marmion (1957) для выявления риккетсий Бернета в селезенке инфицированных мышей.
По мнению Brezina (1959), при переходе риккетсий из I фазы во II фазу происходит лишь перегруппировка антигенных структур, однако после многочисленных пассажей на куриных эмбрионах количество антигена I фазы значительно снижается, а иногда он полностью исчезает.
По мнению Stoker (1957), антиген I фазы обеспечивает более длительное выживание риккетсий в инфицированном организме, так как он препятствует воздействию антител на основной глубинный антиген. Данное обстоятельство, по Stoker, определяет более высокую вирулентность I фазы, чем II фазы риккетсий. Исследования Brezina с соавторами (1963) показали, что сразу после перехода риккетсий из I фазы во II фазу их вирулентность не изменяется. Однако высоковирулентные штаммы, по данным Brezina, менее склонны к фазовой вариации, чем малопатогенные, причем изменение вирулентности различных штаммов при культивировании в куриных зародышах не находится в прямой зависимости от количества пассажей (Brezina, 1959). По данным А. И. Яковлева и А. И. Полозова (1962), фазовая вариация не сопровождается изменением вирулентности риккетсий Бернета.
Наблюдения Fiset (1959) и Brezina с соавторами (1963) свидетельствуют о значительно более высокой токсичности I фазы риккетсий по сравнению со II фазой, что, если учесть отмеченные выше различия в фагоцитозе I и II фазовых вариантов риккетсий, по мнению Brezina и Kazar (1963), указывает на связь антигена I фазы с вирулентностью риккетсий Бернета.
В связи с высказанным мнением о зависимости вирулентности риккетсий Бернета от фазового состояния представляло интерес выявление фазовой характеристики аттенуированного варианта М-44 штамма Грита, рекомендованного в качестве живой вакцины для профилактики Ку-лихорадки у людей (В. А. Генинг, 1960, 1963; П. Ф. Здродовский и В. А. Гениг, 1962).
В наших исследованиях (В. Н. Паутов, 1967) была использована культура штамма М-44, полученная от П. Ф. Здродовского в виде высушенной суспензии из желточных оболочек инфицированных куриных эмбрионов 67-го пассажа и прошедшая дополнительно 2 субпассажа на куриных эмбрионах. В 1 мл стандартной культуры, приготовленной на 10% растворе сахарозы с 0,1% агара и 1,25% желатины (В. Н. Паутов, А. И. Полозов, 1961), содержалось 107 ED50 риккетсий1.
1 (За 1 ЕД50 принята доза риккетсий, обеспечивающая образование к 25-му дню у 50% белых крыс весом 25 - 30 г комплемеит - связывающих антител в титре не менее 1:10)
Как видно из табл. 17, корпускулярный антиген из аттенуированного штамма М-44 реагирует с сыворотками как раннего, так и позднего периода реконвалесценции, т. е. обладает структурой II фазового варианта риккетсий Бернета.
В серии опытов мы изучали динамику комплемент-связывающих антител в сыворотке морских свинок, получивших однократно по 105-106 ED50 штамма М-44 подкожно или энтерально или иммунизированных через конъюнктиву глаза (на конъюнктиву на 30 секунд наносили по 1 - 2 капли культуры штамма М-44 активностью 106 ED50) или подкожно 1 мл убитой корпускулярной вакцины из яичной культуры штамма М-44. Морские свинки контрольных групп получили подкожно или энтерально по 105-106 ED50 культуры II фазы вирулентного штамма Ерита, из которого, как уже отмечалось, был выделен аттенуированный штамм М-44. Оказалось, что в сыворотке всех 83 морских свинок, иммунизированных штаммом М-44 подкожно, энтерально или через конъюнктиву глаза, а также убитой корпускулярной вакциной из штамма М-44, в период с 30-го по 90 - 120-й день содержались антитела только ко II фазовому варианту риккетсий. У всех животных антитела к антигену I фазы отсутствовали, тогда как у всех 20 контрольных животных, зараженных II фазовым вариантом вирулентных риккетсий штамма Грита, были выявлены комплементсвязывающие антитела с антигенам I и II фаз риккетсий Бернета, причем в сыворотке части контрольных морских свинок антитела к антигену I фазы были обнаружены уже на 30-й день и у всех животных на 60-й, 90-й и 120-й день.
В соответствии с нашими наблюдениями после 15 - дневного пребывания в организме белых мышей (2 пассажа через 7 дней) вариант М-44 остался во II фазовом состоянии и не приобрел антигенного компонента I фазы. Введение такого варианта морским свинкам вызывало образование антител только к антигенной субстанции II фазы.
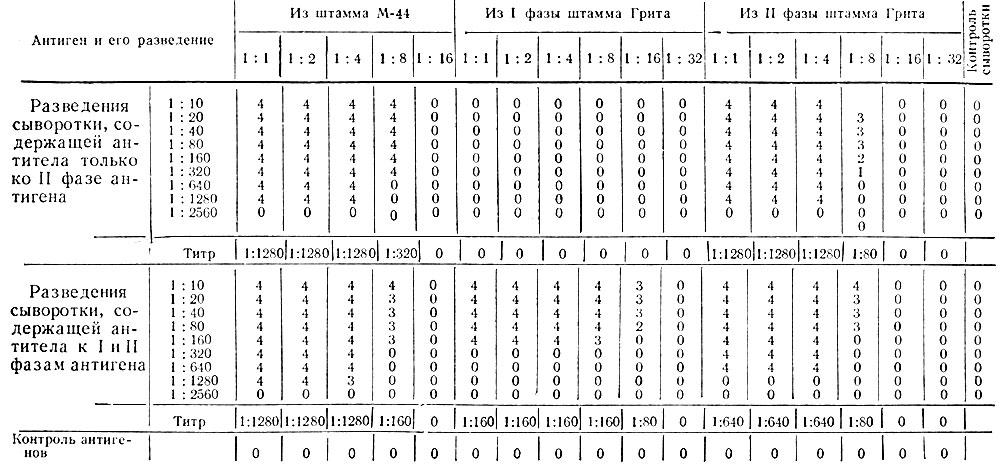
Таблица 17. Крмплементсвязывающая активность антигена из аттенуированного штамма М-44 и I и II фазовых вариантов штамма Грита
Примечание: Исходная концентрация антигенов соответствует 250 млн. микробных клеток по оптическому стандарту. 1, 2, 3, 4 - различные степени задержки гемолиза; 0 - полный гемолиз.
Корпускулярный антиген из риккетсий, выделенных из селезенки мышей, реагировал в реакции связывания комплемента только с антителами II фазы, в частности с антисывороткой раннего периода реконвалесценции.
После длительного (до 17 месяцев - срок наблюдения) пребывания в аргасовых клещах O. papillipes и O. lahorensis антигенная структура варианта М-44 не изменилась1. В сыворотке 56 морских свинок, получивших внутрибрюшинно суспензию из таких клещей, появлялись комплементсвязывающие антитела только к антигену II фазы.
1 (Исследования выполнены совместно с Ю. И. Морозовым)
Таким образом, можно считать, что аттенуированный штамм М-44 обладает антигенной структурой, свойственной II фазовому варианту риккетсий Бернета, но в отличие от II фазы вирулентных риккетсий штамма Грита он при различных путях введения не обеспечивает появления в сыворотке морских свинок антител к антигенному компоненту I фазы. Данное обстоятельство позволяет оценить вариант М-44 как "чистую" II фазу риккетсий Бернета, тогда как II фаза вирулентного штамма Грита содержит некоторое количество антигена I фазы, который выявляется с помощью трихлоруксусной кислоты (см. ниже).
Рядом исследователей было сделано заключение о наличии в сыворотке человека антител против I фазы риккетсий при хроническом течении Ку-лихорадки, в частности при эндокардите (Andrews и Marmion, 1959; Marmion с соавторами, 1960; Marmion, 1962; Grist, 1963). Однако, по мнению Powell и Stallman (1962), наличие антител к I фазе риккетсий хотя и свидетельствует о персистирующем течении Ку-лихорадки, но не позволяет делать окончательное заключение о хронической форме заболевания.
Исследования Mikolajczyk (1963) свидетельствуют о том, что II фаза риккетсий адсорбирует антитела II фазы, но не адсорбирует антитела к I фазе антигена, тогда как I фаза риккетсий слабо адсобирует антитела I и II фаз или вообще их не адсорбирует.
Несомненный интерес представляют наблюдения Abinanti и Marmion (1957) о значении антител к I и II фазам риккетсий в иммунитете против Ку-лихорадки. Так, в опытах на белых мышах было показано, что защитное свойство сыворотки обусловлено наличием в ней комплементсвязывающих антител против I фазы риккетсий. После удаления антител ко II фазе риккетсий сыворотка сохраняла защитные свойства, но после удаления антител к I фазе сыворотка лишалась способности защищать животных от развития Ку-лихорадки.
По данным Н. И. Федоровой и Р. Г. Дюйсалиевой (1963), морские свинки, иммунизированные вакциной из риккетсий I фазы, более резистентны к заражению вирулентной культурой I фазы риккетсий, чем животные, иммунизированные аналогичными препаратами из риккетсий II фазы, хотя в сыворотке последних в достаточно высоком титре содержались антитела к антигену II фазы. В опытах на белых мышах и кроликах авторы не выявили достоверных различий в защитных свойствах сывороток, содержащих антитела только против II фазы или же против I и II фаз риккетсий.
Нами в опытах на морских свинках было проведено сравнительное изучение вакцин, полученных из культур риккетсий после различного количества пассажей на куриных эмбрионах и, следовательно, отличающихся по фазовому состоянию. В опытах использовали штамм Грита и выделенный из него аттенуированный вариант М-44. Кроме того, использовали вакцину серии № 2 - 1 (контрольный номер 375), изготовленную в Институте эпидемиологии и микробиологии имени Н. Ф. Гамалеи АМН СССР из культуры риккетсий (штамм Грита), прошедших многочисленные пассажи на куриных эмбрионах и утративших патогенность (А. Г. Сомова, Л. Г. Герасюк, 1956; В. А. Гениг, 1963).
Результаты исследований свидетельствуют о существенных различиях в иммуногенности убитых корпускулярных вакцин, приготовленных из различных фазовых вариантов риккетсий Бернета. Так, вакцина из I фазового варианта обеспечила появление в ранние сроки в сыворотке всех 14 животных комплементсвязывающих антител к антигену II фазы, а к 60-му дню у абсолютного большинства морских свинок (у 10 из 11) антител против антигена I фазы. Аналогичная вакцина из переходной фазы риккетсий (из яичной культуры 10-го пассажа) обеспечила образование у всех 49 морских свинок антител против антигена II фазы. Однако антитела против антигена I фазы до 45-го дня у всех свинок отсутствовали, на 90-й день имелись в сыворотке 12 из 29 животных, а на 120-й день - у 5 из 35 обследованных морских свинок. Вакцины, приготовленные из аттенуированного варианта риккетсий Бернета, обеспечили появление в сыворотке всех 18 животных антител только против антигена II фазы.
Исследования Fiset (1957, 1959), Brezina (1959), Bobb и Downs (1962), Н. И. Федоровой и Р. Г. Дюйсалиевой (1963) также показали, что если вакцина из риккетсий I фазы стимулирует образование двух типов комплементсвязывающих антител к антигенам I и II фаз, то вакцина из риккетсий II фазы обеспечивает выработку антител только к антигену II фазы.
Наблюдения Ormsbee с соавторами (1964) свидетельствуют о существенных различиях в иммуногенности убитых корпускулярных вакцин, приготовленных из I или II фазовых вариантов риккетсий. Так, в случае заражения животных культурой риккетсий I фазы вакцины из I фазы риккетсий оказались в 100 - 300 раз более эффективными, чем вакцины из II фазы риккетсий. Однако при контрольном заражении морских свинок культурой риккетсий II фазы оба типа вакцины оказались одинаково эффективными. По мнению авторов, различия в иммуногенности отдельных серий вакцины зависят не от особенностей использованных для их изготовления штаммов риккетсий, а от фазового состояния штамма, что и было продемонстрировано на примере штаммов Nine Mile, California 16, Henzerling и Ohio314.
Таким образом, многочисленные наблюдения убедительно свидетельствуют о том, что убитые корпускулярные вакцины из I фазы риккетсий Бернета обладают более выраженной иммунологической активностью, чем вакцины из II фазы риккетсий.
В свете этих данных возможно по-новому оценить ранние исследования иммуногенности вакцин, в частности исследования Smadel и соавторов (1948), и предположить, что выявлявшиеся ими отличия в активности вакцин, вероятнее всего, были обусловлены именно фазовым различием риккетсии в культурах, использованных для изготовления отдельных серий вакцины.
Поскольку в естественных условиях риккетсии Бернета находятся в I фазовом варианте и, следовательно, инфицирование людей происходит именно I фазой риккетсий, для изготовления вакцин необходимо использовать культуры I фазы риккетсий, так как эффективность таких препаратов превышает эффективность препаратов, полученных из II фазы риккетсий. В связи с этим необходимо отметить, что использованные в Советском Союзе для иммунизации людей образцы вакцины были изготовлены из различных культур риккетсий. Так, для изготовления убитой вакцины в 1955 г. в Институте эпидемиологии и микробиологии имени Н. Ф. Гамалеи АМН СССР (серия № 2 - 1, контрольный номер 375) был использован малопатогенный вариант штамма Грита (Л. В. Васильева, В. А. Яблонская, 1955; В. А. Гениг, 1963, и др.), который в соответствии с нашими данными является типичным II фазовым вариантом риккетсий Бернета. В опытах Н. Н. Уракова с соавторами (1962), как показали наши исследования, применялась вакцина из переходной фазы штамма Грита, так как для ее изготовления была использована культура 7 - 8-го пассажа на куриных эмбрионах. Наконец, вакцины, изготовленные в Ташкентском научно-исследовательском институте вакцин и сывороток из селезенки инфицированных белых мышей, вероятнее всего, представляют препараты I фазы риккетсий (Н. И. Ходукин и соавторы, 1956 1960).
При переходе из I во II фазу риккетсии Бернета, вероятно, изменяют антигенную структуру, выявляемую в реакции связывания комплемента, быстрее, чем иммуногенность. Об этом, в частности, свидетельствуют данные Bobb и Downs (1962) о появлении в сыворотке морских свинок, ранее иммунизированных вакциной из риккетсий II фазы, после повторного внутрикожного введения вакцины антител к I фазе риккетсий, хотя после первичной иммунизации в сыворотке животных содержались антитела только к антигену II фазы.
С целью более подробной характеристики антигенной структуры риккетсий Бернета, в частности аттенуированного варианта М-44, мы в серии исследований оценивали динамику образования комплементсвязывающих антител в сыворотке морских свинок, комбинированно иммунизированных убитой корпускулярной вакциной и вариантом М-44, и животных, ревакцинированных спустя б месяцев после первичной иммунизации. Оказалось, что комбинированная иммунизация обеспечивает выработку комплементсвязывающих антител в более высоком тигре, чем иммунизация только убитой вакциной или только вариантом М-44, причем существенные различия были обнаружены в динамике антител к антигену I фазового варианта риккетсий. Так, однократная подкожная инъекция убитой корпускулярной вакцины из переходной фазы риккетсий Бернета не обеспечивала появление к 30-му и 45-му дню в сыворотке морских свинок антител к антигену I фазового варианта риккетсий. На 90-й день данный тип антител был обнаружен в сыворотке 12 из 29 обследованных морских свинок, а через 120 дней - у 5 из 40 животных. Однократная инъекция варианта М-44, как и в других опытах, не обеспечила ни у одного животного образования антител к антигену I фазы риккетсий Бернета. В сыворотке же большинства комбинированно иммунизированных морских свинок были обнаружены антитела к I фазовому варианту риккетсий. Так, в группе животных, одновременно иммунизированных убитой вакциной и вариантом М-44, на 45-й день антитела I фазы содержались в сыворотке 14 из 20 обследованных морских свинок, на 60-й день - у 15 из 19 животных, на 90-й день - у 17 из 18 свинок и на 120-й день - у 13 из 14 животных.
Более выраженная иммуногенная активность комбинированой иммунизации, чем иммунизации только убитой вакциной или только вариантом М-44, была выявлена также при ревакцинации с интервалом 10, 20 или 30 дней. Так, в сыворотке комбинированно иммунизированных морских свинок титр антител к антигенам как II, так и I фазовых вариантов риккетсий значительно превышал соответствующие показатели у контрольных животных. Судя по уровню антител через 45 дней, проведение ревакцинации вариантом М-44 на 20 - 30-й день после иммунизации убитой вакциной обеспечивает появление антител в несколько более высоком титре, чем при одновременной комбинированной иммунизации или при иммунизации с интервалом 10 суток.
Однократная инъекция убитой корпускулярной вакцины в разведении свыше 1:16 хотя и не обеспечивает появления в сыворотке морских свинок комплементсвязывающих антител, но стимулирует образование антител при последующем введении варианта М-44. Указанное явление было обнаружено при использовании убитой вакцины даже в разведении 1:64, которое соответствует концентрации риккетсий по оптическому стандарту 3,9 млн. микробных клеток (исходная вакцина содержала 250 млн. риккетсий по оптическому стандарту).
В случае ревакцинации морских свинок вариантом М-44 через 4 месяца после первичной иммунизации живой вакциной в сыворотке абсолютного большинства животных (у 21 из 22) уже на 10-й день были обнаружены антитела против антигена I фазы риккетсий. До ревакцинации этот тип антител не был выявлен ни у одной из свинок.
В связи с оценкой фазового состояния варианта М-44 весьма интересным представляется более интенсивное образование комплементсвязывающих антител к антигену I фазы при комбинированной иммунизации убитой и живой вакцинами, чем при инъекции только убитой корпускулярной вакцины из переходной фазы риккетсий, а также образование данного типа антител при отдаленной ревакцинации вариантом М-44. Таким образом, антигенная структура варианта М-44 хотя и не обеспечивает выработку антител I фазы при однократном введении, но обеспечивает быстрое образование этого типа антител при повторном введении как варианта М-44, так и убитой вакцины из переходной фазы риккетсий, что свидетельствует о наличии у варианта М-44 риккетсий Бернета антигенной группировки, в определенной степени ответственной за образование антител I фазы.
Исследования Brezina и Urvolgyi (1961, 1962) и Anacker с соавторами (1961, 1962) выявили возможность выделения из риккетсий I фазы с помощью трихлоруксусной кислоты по методу Буавена растворимого антигена, который реагирует в реакции связывания комплемента подобно корпускулярному антигену I фазы.
Как свидетельствуют наблюдения Fiset (1955, 1959), Brezina и Urvolgyi (1962), перйодат калия разрушает антигенный компонент I фазы в корпускулярном и в растворимом препаратах. Данное обстоятельство позволило предположить полисахаридную природу антигена I фазы. Исследования Ormsbee с соавторами (1962) указывают на возможность экстрагирования антигена I фазы с помощью диметилсульфоксида и диметилацетамида, т. е. растворителями различных полимеров, что также свидетельствует о полисахаридной структуре антигена. По данным Brezina с соавторами (1962), высокоочищенный антигенный компонент I фазы риккетсий содержит 95% полисахаридов и 5% белка. Однако Ormsbee с соавторами (1962) ультрафиолетовой спектроскопией не выявили протеина в растворимом антигене, полученном с помощью диметилсульфоксида и диметилацетамида.
Полисахаридная природа компонента (или компонентов) I фазы риккетсий Бернета была показана Ваkemeier (1965) с помощью реакции гемагглютинации. Антигенный компонент, присущий I фазе риккетсий, в небольшом количестве был обнаружен и в культуре II фазы. В качестве II фазы автор использовал культуру вирулентного штамма Nine Mile 50 - 60-го пассажа в развивающихся куриных эмбрионах.
Растворимый антиген I фазы удалось выделить не только из риккетсий, находящихся в I фазе, но и из риккетсий, недавно перешедших во II фазу. В то же время из штаммов, многократно пассированных на куриных эмбрионах, в частности из штамма Nine Mile, получить растворимый антиген не удалось (Ormsbee с соавторами, 1962; Brezina с соавторами, 1963).
Наши исследования, проведенные совместно с А. А. Воробьевым, И. С. Корневым и А. А. Мордуевой (1964), показали, что с помощью трихлоруксусной кислоты растворимый антиген I фазы удается выделить не только из риккетсий Бернета (штамм Брита), прошедших 2 пассажа на развивающихся куриных эмбрионах и находящихся в I фазе, но и из культуры, прошедшей свыше 20 пассажей на куриных эмбрионах и реагирующей в реакции связывания комплемента как антиген II фазы. При аналогичной обработке трихлоруксусной кислотой яичных культур аттенуированного варианта М-44 растворимый антиген I фазы не был выделен. Следовательно, обладая в реакции связывания комплемента одинаковой антигенной активностью, вирулентная культура II фазы риккетсий Бернета содержит некоторое количество антигена I фазы, тогда как аттенуированный вариант М-44 того же штамма Грита лишен данной антигенной субстанции. Таким образом, можно полагать, что утрата штаммом Грита патогенности и превращение его в аттенуированный вариант М-44 сопряжены с утратой антигенной субстанции, характерной для I фазового варианта риккетсий Бернета, и превращением в "чистую" II фазу. О правомочности такого заключения свидетельствуют данные об отсутствии в сыворотке морских свинок антител к антигену I фазы после иммунизации вариантом М-44 или приготовленной из него убитой корпускулярной вакциной. Вместе с тем комбинированная иммунизация убитой корпускулярной вакциной из переходной фазы риккетсий и живой вакциной (штаммом М-44) и двукратная вакцинация живой вакциной обеспечивают значительную стимуляцию образования антител к антигену I фазы по сравнению с той, которая возникает при инъекции только убитой вакцины из риккетсий переходной фазы или живой вакцины. Эти наблюдения позволяют предполагать наличие у штамма М-44 таких антигенных структур, которые не выявляются как антиген I фазы, но в некоторой степени стимулируют образование антител к этому антигену.
По данным Brezina с соавторами (1962), растворимый антиген I фазы не обладает иммуногенностью. Однако в опытах Anacker с соавторами (1962) после инъекции растворимого антигена I фазы в сыворотке морских свинок появлялись комплементсвязывающие антитела к антигену II фазы и агглютинины; антитела же К антигену I фазы не образовались. Несмотря на высокую активность в реакции связывания комплемента, иммуногенность растворимого антигена (с учетом дозы антигена по реакции связывания комплемента) была примерно в 10 - 20 раз меньше, чем у корпускулярных вакцин. Однако для положительной кожной реакции у сенсибилизированных кроликов требуется инъекция растворимого антигена, полученного с помощью трихлоруксусной кислоты, в дозе, в 100 раз превышающей дозу корпускулярной вакцины (Anacker с соавторами, 1962). По данным Ormsbee с соавторами (1962), протективные свойства растворимого антигена, полученного с помощью диметилсульфоксида и диметилацетамида, лишь немного меньше, чем у корпускулярного антигена, хотя с учетом сухого веса растворимый антиген гораздо активнее в реакции связывания комплемента и содержит значительно меньше азота. Растворимый антиген оказался гораздо менее токсичным и менее реактогенным для сенсибилизированных морских свинок и кроликов, чем корпускулярный антиген.
Исследования, проведенные нами совместно с А. А. Воробьевым, И. С. Корневым и А. А. Мордуевой (1964), показали, что иммуногенность растворимого антигена I фазы риккетсий Бернета, полученного с помощью трихлоруксусной кислоты, с учетом активности в реакции связывания комплемента, значительно ниже, чем иммуногенность корпускулярного антигена. Так, однократное подкожное введение морским свинкам 1 мл препаратов растворимого антигена с титром 1:8 - 1:16, а в части опытов - препаратов с титром 1:32 - 1:128 у многих животных не обеспечивало образования комплементсвязывающих антител, причем такие морские свинки оставались восприимчивыми к вирулентной культуре риккетсий Бернета. В то же время корпускулярный антиген обладал высокой иммуногенностью даже при титре 1:2.
В сыворотке морских свинок, иммунизированных растворимым антигеном I фазы, комплементсвязывающие антитела ко II фазе риккетсий закономерно удавалось выявить в случае инъекции животному не менее 256 - 1024 единиц связывания антигенной субстанции. При увеличении дозы вводимого растворимого антигена титр антител к антигену II фазы возрастал, причем после инъекции 1 мл препарата с титром 1:8192 - 1:32768 отмечалось весьма высокое содержание антител. Средний геометрический титр антител к антигену II фазы у таких животных достигал к 20 - 30-му дню 1:320 - 1:2875.
После однократной инъекции не менее 2048 единиц связывания растворимого антигена I фазы у абсолютного большинства морских свинок на 10-й день в довольно высоком тигре содержались комплементсвязывающие антитела к антигену II фазы. К 20-му дню титр антител повышался, но уже к 30-му дню несколько снижался, а в дальнейшем прогрессивно уменьшался.
Антитела к антигену I фазы риккетсий были обнаружены в низком титре на 45 - 90-й день в сыворотке лишь отдельных животных, иммунизированных растворимым антигеном. Практически все морские свинки, в сыворотке которых были обнаружены комплементсвязывающие антитела к антигену II фазы риккетсий, через 60 - 90 дней оказались невосприимчивыми к 104 ED50 вирулентной культуры возбудителя Ку-лихорадки.
Растворимый антиген I фазы, сорбированный гидратом окиси алюминия [до сорбции в 1 мл раствора содержалось 1024 - 2048 единиц связывания антигена, степень сорбции составляла 81 - 85% к исходному раствору, содержание Al (OH)3 в 1 мл сорбированного препарата 11,1 мг], так же, как и несорбированный антиген, обеспечил появление в сыворотке морских свинок комплемент - связывающих антител к антигену II фазы и лишь у отдельных животных антител к антигену I фазы (в низком титре). Оценить содержание антигенной субстанции в сорбированных препаратах с помощью реакции связывания комплемента не удается, так как гидрат окиси алюминия обладает выраженной антикомплементарностью. Все 14 морских свинок, иммунизированных сорбированным растворимым антигеном, спустя 90 дней оказались невосприимчивыми к 104 ED50 вирулентной культуры риккетсий Бернета.
Проведенные исследования свидетельствуют об иммуногенной полноценности растворимого антигена, извлекаемого трихлоруксусной кислотой из I фазы риккетсий Бернета.
При отдаленной (через 110 - 135 дней) однократной подкожной инъекции растворимого антигена из I фазы риккетсий Бернета в дозе 2048 единиц связывания в сыворотке морских свинок на 4 - 6-й день появлялись комплементсвязывающие антитела к антигену II фазы в титре, значительно превышающем титр антител у первично иммунизированных животных. В сыворотке абсолютного большинства морских свинок на 7 - 13-й день и у всех животных на 20 - 60-й день после ревакцинации растворимым антигеном содержались комплементсвязывающие антитела к антигену I фазы риккетсий, которые, как правило, отсутствовали в сыворотке первично иммунизированных морских свинок.
В соответствии с исследованиями Anacker с соавторами (1963) растворимый антиген I фазы после обработки фенолом остается активным в реакции связывания комплемента, но утрачивает иммуногенность, что, по мнению авторов, обусловлено удалением из него белка и превращением в гаптен.
Растворимый антиген I фазы и полученный из него гаптен, как свидетельствуют наблюдения Brezina с соавторами (1965), обладают пирогенным действием при внутрибрюшинном введении морским свинкам. Пирогенное действие антигена нейтрализуется специфической антисывороткой, содержащей комплементсвязывающие антитела к антигену I фазы, но не нейтрализуется сывороткой, содержащей антитела только против антигена II фазы. Одновременно антиген I фазы утрачивает и защитное свойство. Внутрибрюшинное введение растворимого антигена и гаптена обеспечило невосприимчивость морских свинок к пирогенному действию антигена и риккетсий Бернета.
Отсутствие корреляции между активностью в реакции связывания комплемента и иммуногенностью у растворимого антигена и корпускулярной вакцины позволило Anacker с соавторами (1963) предположить, что активность в реакции связывания комплемента не может являться единственным показателем для оценки протективных свойств фракций риккетсий Бернета. При этом авторы предполагают по крайней мере три возможности: 1) антигенный компонент I фазы, выявляемый в реакции связывания комплемента, и протективный антиген отличаются друг от друга и представляют различные части стенки риккетсии; 2) растворимый антиген выводится из организма быстрее, чем корпускулярный антиген, ввиду чего он является менее активным иммуногеном; 3) в препаратах корпускулярного антигена содержатся вещества, обеспечивающие иммунную перестройку организма, которые отсутствуют в растворимом антигене. В настоящее время, однако, ни одна из этих гипотез не получила экспериментальных подтверждений.
На основании имеющихся в литературе данных и результатов наших исследований можно сопоставить отдельные свойства I и II фазовых вариантов риккетсий Бернета, а также свойства вакцинного штамма М-44 (табл. 18).
Учитывая большое практическое значение точной оценки фазового состояния риккетсий Бернета, при изготовлении профилактических и диагностических препаратов культуры риккетсий следует контролировать хотя бы по трем показателям: I) антигенная активность в реакции связывания комплемента в присутствии ранней и поздней иммунных сывороток; 2) наличие растворимого антигена I фазы, выделяемого с помощью трихлоруксусной кислоты; 3) характер комплементсвязывающих антител, образуемых у морских свинок после однократной инъекции корпускулярного антигена (вакцины), приготовленного из обследуемой культуры. При проведении дифференциации фазового состояния культур мы рекомендуем пользоваться тестами, представленными в табл. 19.
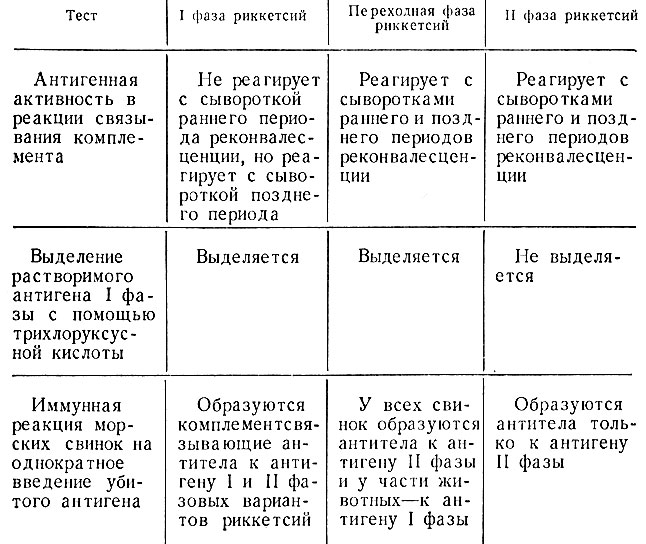
Таблица 19. Тесты для дифференциации фазового состояния риккетсий Бернета
Таким образом, полученные к настоящему времени данные свидетельствуют о большом влиянии фазовой вариации риккетсий Бернета на активность диагностических и профилактических препаратов, что определяет необходимость строгого отбора пригодных для их изготовления культур.
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
