
Глава 9. Изменчивость и наследственность у возбудителей группы клещевых пятнистых лихорадок
Сравнительное изучение представителей различных форм клещевых риккетсиозов выявило близость их антигенной структуры, культуральных свойств (например, оптимальных условий размножения в куриных эмбрионах и способность к внутриядерному размножению), морфологии и ряда других признаков. Так, исследования Mason и Alexander (1939) выявили родство южноафриканской формы клещевого риккетсиоза с марсельской лихорадкой. Lackman и Parker (1948) установили общность возбудителя клещевого риккетсиоза Северного Квинсленда с риккетсиями Риккетса и риккетсиями Конора.
Исследования Heisch (1957) позволили предположить близость возбудителя кенийского клещевого риккетсиоза с возбудителем марсельской лихорадки, что было затем доказано, в частности Е. М. Голиневич (1960), серологическим сравнением этих культур. Topping с соавторами (1943) показали родство возбудителя индийского клещевого риккетсиоза с возбудителем пятнистой лихорадки Скалистых гор.
Серологический анализ возбудителя клещевого сыпного тифа Северной Азии, проведенный Е. М. Голиневич (1952), выявил, что его антигенная структура весьма сходна с возбудителем марсельской лихорадки.
Опыты Bell и Stoenner (1960) с перекрестной нейтрализацией токсина риккетсий антисывороткой также показали наличие определенного родства между возбудителями отдельных форм пятнистой лихорадки Скалистых гор, географических вариантов марсельской лихорадки и возбудителем клещевого сыпного тифа Северной Азии, а также риккетсиями, выделенными из клещей Н. leporis-palustris и A. maculatum. В то же время среди различных штаммов одного вида риккетсий были обнаружены некоторые различия. Так, например, антисыворотка к штамму R риккетсий Риккетса гораздо хуже нейтрализовала токсин других видов риккетсий, чем антисыворотки к штаммам Sao Paulo и Bizek.
В итоге многочисленных исследований возбудители пятнистой лихорадки Скалистых гор, бразильского сыпного тифа, или сыпного тифа Сан-Паоло, марсельской, или средиземноморской, лихорадки, южноафриканского и восточноафриканского клещевого тифа, клещевого сыпного тифа Северной Азии, североавстралийсхого клещевого сыпного тифа и осповидного, или везикулезного, риккетсиоза были объединены по совокупности общих признаков в одну группу клещевой пятнистой лихорадки с родовым единством возбудителя - Dermacentroxenus (П. Ф. Здродовский и Е. М. Голиневич, 1956).
Оценивая эволюцию представителей весьма обширной группы клещевых пятнистых лихорадок, прежде всего необходимо учитывать резкие отличия в условиях их обитания. Так, в отдельных эндемичных очагах первичными хозяевами риккетсий являются различные виды клещей. Одновременно могут резко отличаться и хозяева клещей, которые вовлекаются в циркуляцию риккетсий. Все эти особенности существования риккетсий в конкретных условиях внешней среды могут обусловливать те или иные изменения свойств риккетсий. Так, например, в соответствии с мнением Weyer (1961) возбудитель пятнистой болезни Американского континента является мутантом риккетсий Риккетса, который адаптировался к клещам Amblyomma maculatum и изменил при этом патогенность для человека.
Один из представителей клещевых риккетсиозов - возбудитель пятнистой лихорадки Скалистых гор - явился первым объектом (из всей группы возбудителей инфекционных заболеваний, объединенных ныне под общим названием "риккетсиозы") систематического изучения. Многолетнее изучение риккетсий Риккетса позволило выявить ряд особенностей, присущих, вероятно, и другим представителям клещевых риккетсиозов, но в силу ряда обстоятельств пока еще у них не выявленных. Поэтому, оценивая проблему наследственности и изменчивости у возбудителей клещевых риккетсиозов, основное внимание мы уделили обобщению данных о наиболее изученном представителе этой группы - риккетсиях Риккетса, чтобы на этом примере иллюстрировать весьма своеобразные формы изменчивости.
Многолетние исследования убедительно свидетельствуют о широкой вариации клинических проявлений пятнистой лихорадки Скалистых гор у людей - от очень тяжелых, обычно смертельных форм до легких, а иногда даже бессимптомных форм. Так, по данным Fricks (1914), в одном очаге пятнистой лихорадки Скалистых гор из 992 больных погибло 26 человек (2,6%), во втором очаге из 37 заболевших погибло 22 человека (59%), в третьем очаге пятнистой лихорадки Скалистых гор не умер ни один из 253 заболевших. В соответствии со сводными данными Badger, за 12 лет (с 1917 по 1928 г.) летальность от пятнистой лихорадки в штате Айдахо была около 5%, в ряде природных очагов в штате Монтана - 30%, а в долине Биттер Рут в Западной Монтане достигала 76,8%. Многолетние наблюдения свидетельствуют о том, что вирулентность риккетсий Риккетса в большинстве очагов пятнистой лихорадки Скалистых гор длительное время остается постоянной (Parker, 1938; Toomey, 1931). Так, с 1906 по 1938 г. в эндемичном очаге в долине Биттер Рут летальность среди взрослого населения достигала примерно 80%, а среди детей - примерно 37%. Однако в некоторых очагах вирулентность местных штаммов риккетсий изменилась. Так, например, как свидетельствуют данные Parker (1938), в эндемичном очаге в южной части штата Айдахо в начале XX века летальность была около 5%, а к 1938 г. повысилась до 25 - 35%.
Начиная с исследований Ricketts до настоящего времени вирулентность отдельных штаммов возбудителя пятнистой лихорадки Скалистых гор оценивают главным образом по характеру заболевания у морских свинок. Первоначально штаммы риккетсий Риккетса, вызывающие у морских свинок тяжелое, часто смертельное заболевание, с выраженной лихорадкой, геморрагическими поражениями кожи и отчетливым скротальным феноменом (периорхитом), были объединены в группу "высоковирулентных штаммов". Штаммы, вызывающие у морских свинок лишь доброкачественное лихорадочное заболевание, которое протекает без поражения кожи и периорхита и не вызывает гибели животных, были отнесены к группе "маловирулентных штаммов".
Сравнительное изучение различных штаммов риккетсий Риккетса показало существенные отличия в клинической картине экспериментальной инфекции у морских свинок. Так, бразильские штаммы вызывают гибель морских свинок еще до развития периорхита (Piza с соавторами, 1931), тогда как после инъекции ряда других штаммов заболевание сопровождается выраженным периорхитом, однако животные не погибают. По данным Topping и Dyer (1940), некоторые штаммы риккетсий Риккетса из западных районов США вызывают гибель 82% морских свинок, а штаммы из восточных районов - гибель от 34 до 86% животных. В опытах Cox (1938) отдельные штаммы риккетсий Риккетса обеспечивали развитие смертельного заболевания у всех морских свинок.
Большой интерес представляют данные Price (1953, 1954) о патогенности выделенных в США штаммов риккетсий Риккетса. Основываясь на реакции самцов морских свинок весом 400 - 500 г на внутрибрюшинное введение 104 ED50 риккетсий, Price разделил все штаммы риккетсий Риккетса на четыре типа: R, S, T и U, сравнительная характеристика которых представлена в табл. 20.
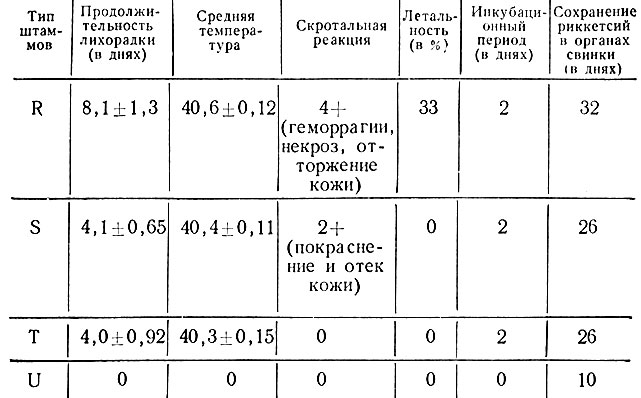
Таблица 20. Сравнительная вирулентность различных типов штаммов риккетсий Риккетса для морских свинок (по Price, 1954)
Примечание. Морским свинкам внутрибрюшинно вводили по 104 ED50 риккетсий.
В соответствии с классификацией Price наиболее вирулентными являются штаммы типа R, а наименее вирулентными - типа U, которые не вызывают в дозе 104 ED50 у морских свинок даже повышения температуры.
По данным Price (1954), среди штаммов типа U можно выделить два подтипа: восточный и западный. Один из них полностью сохраняет свои свойства при пассажах на куриных эмбрионах, а другой при этом быстро изменяется и уже после 1 - 2 пассажей становится подобным штаммам типа T.
Наконец, по мнению Price с соавторами (1961), внутри типа U можно выделить два подтипа штаммов, обозначаемых как U1 и U2. Яичные культуры этих подтипов хотя и не обеспечивают у морских свинок клинических признаков заболевания, но вызывают образование комплементсвязывающих и нейтрализующих токсин антител, а также приобретение животными невосприимчивости к вирулентным культурам риккетсий. Вместе с тем клещи D. andersoni успешно заражаются при кормлении на морских свинках, инфицированных яичными культурами риккетсий подтипа U2, тогда как заражение клещей подтипом U1 обеспечивается только при введении культур риккетсий в кишку. После пребывания в клещах в течение 8 дней (температура 35 - 37°) риккетсии подтипа U1 приобретают способность вызывать у морских свинок заболевание, сходное с заболеванием, которое наблюдается при инъекции штамма типа S. Заболевание, однако, протекает значительно доброкачественнее, но сопровождается риккетсиемией, что позволяет заражать клещей кормлением на больных свинках. Однако после 1 - 2 пассажей на куриных эмбрионах риккетсии приобретают исходные свойства. По мнению авторов, в природных условиях штаммы подтипа U1 обладают достаточно высокой вирулентностью для морских свинок и приближаются по этому признаку к риккетсиям типа S, с которыми они, однако, не идентичны. При выделении и выращивании в развивающихся куриных эмбрионах штаммы подтипа U1 быстро становятся маловирулентными для морских свинок.
Инфицирование 50% морских свинок происходит при инъекции от 20 - 100 до 50 - 200 риккетсий типов R, S или T (Price, 1953, 1954). Все четыре типа штаммов инфицируют 5 - дневные куриные зародыши при инъекции 1 - 10 телец риккетсий и обеспечивают гибель 50% куриных эмбрионов при введении от 20 - 100 до 50 - 200 риккетсий (Price, 1953, 1954). Количество риккетсий, соответствующее 1 LD50 токсина (для белых мышей) и 1 единице гемолитического фактора, у всех четырех типов штаммов оказалось одинаковым.
Как свидетельствуют наблюдения Price, все четыре типа штаммов риккетсий Риккетса иммунологически близки, хотя по антигенной структуре они несколько различаются. Так, морские свинки, ранее инфицированные 104 ED50 риккетсий штаммов типов R, S, T или U, невосприимчивы к 102 ED50 как гомологичного, так и гетерологичного штамма риккетсий. Однако животные, иммунизированные инактивированными эфиром риккетсиями, обладали большей устойчивостью к 10 ED50 риккетсий гомологичного штамма, чем к той же дозе гетерологичного штамма (Price, 1953, 1954). Несмотря на существенные различия вирулентности, штаммы риккетсий типов R, S и T обеспечивали появление в сыворотке животных комплементсвязывающих антител в одинаковые сроки и в равных титрах (Price, 1953).
Попытка биохимической дифференциации штаммов риккетсий Риккетса по способности к окислительному фосфорилированию, анаэробному потреблению глюкозы и окислению жирных кислот оказалась безуспешной (Price, 1953). Штаммы типов R и T, обладающие высокой и относительно незначительной вирулентностью для морских свинок, содержали одинаковое количество дезоксирибонуклеиновой кислоты (около 10%), пуринов и пиримидинов (для штаммов типов R и T соответственно аденина 33,4 и 32,1%, гуанина 19,4 и 18,2%, тимина 29,2 и 28,1% и цитозина 18,1 и 17,3%), окисляли эфир яблочной кислоты и альфа - кетоглютарат и обладали высокой окислительной способностью в отношении глюкозы. Пробы с гликолитическими реакциями со штаммами типов R и T были отрицательными даже в присутствии кофакторов. Штаммы типов R и T не окисляли глюконовые и жирные кислоты, в том числе и после добавления кофакторов. Таким образом, хотя и было установлено, что риккетсии Риккетса окисляют некоторые промежуточные вещества в цикле Кребса, однако не удалось выявить каких - либо различий в энзимной активности штаммов типов R и T (Price, 1953).
Высоковирулентные штаммы риккетсий Риккетса (тип R) были выделены от больных людей и из клещей D. andersoni и D. variabilis (Brigham и Watt, 1940), штаммы типа S - от больных людей и из клещей D. andersoni и H. leporis - palustris, штаммы типа T - от больных людей (Price, 1954) и из клещей D. andersoni, D. variabilis, H. leporis - palustris и I. dentatus (Parker с соавторами, 1951, 1952), а штаммы типа U - из клещей D. andersoni, D. variabilis, H. leporis - palustris и I. dentatus.
В соответствии с данными Bell с соавторами (1963) на территории США преобладающий тип риккетсий Риккетса зависит от вида клеща и локализации очага. Так, в восточной части США около 90% риккетсий Риккетса, выделенных из клещей D. variabilis, обладали свойствами типа T, в долине Биттер Рут в штате Монтана 90% штаммов, выделенных из клещей D. andersoni, относились к типам R и U, а в восточных и западных частях США из клещей H. leporis - palustris, как правило, удавалось выделить штаммы типа S.
Тяжесть клинической картины пятнистой лихорадки Скалистых гор у людей, вероятно, не находится в прямой зависимости с вирулентностью штаммов для морских свинок. Так, при очень тяжелых формах пятнистой лихорадки от больных людей были выделены штаммы как типа R, так и типа T, которые значительно отличаются по патогенности для морских свинок (Price, 1954).
Данное обстоятельство свидетельствует об условности рекомендованной Price классификации штаммов риккетсий Риккетса на основании их вирулентности для морских свинок.
В дополнение к данным Price исследования Bell с соавторами (1963) выявили наличие на территории США значительного количества клещей - носителей риккетсий, родственных риккетсиям Риккетса, но непатогенных для морских свинок, в том числе и после серийных пассажей на куриных эмбрионах. Количество клещей D. variabilis, содержащих данные риккетсии, достигало 6 - 8%. Эти риккетсии, названные ЕМ, отличались от непатогенного типа U риккетсий Риккетса. Детальное изучение риккетсий EM (изучено 40 штаммов), выделенных из клещей D. variabilis и D. andersoni, показало, что они отличаются от авирулентного штамма типа U способностью давать перекрестную нейтрализацию токсина с вирулентным штаммом типа R. Так, у морских свинок, инфицированных по 104 доз риккетсий ЕМ, обнаруживался высокий титр комплементсвязывающих антител, но низкий уровень антитоксина против штамма типа R, тогда как штаммы типа U обеспечивали образование в высоком титре "как комплементсвязывающих антител, так и антител, нейтрализующих токсин вирулентного штамма R. Гипериммунная сыворотка морских свинок против риккетсий группы ЕМ нейтрализовала токсины трех типов риккетсий Риккетса (группы R, S и T), но не нейтрализовала токсины возбудителей марсельской лихорадки, клещевого сыпного тифа Северной Азии и риккетсий, выделенных из клещей Amblyomma maculatum (возбудитель так называемой пятнистой болезни).
Кроме отмеченных выше наследственно закрепленных различий между отдельными штаммами риккетсий Риккетса, были выявлены обратимые изменения патогенности риккетсий Риккетса, зависящие не от особенностей штамма, а от условий нахождения риккетсий. Так, еще в 1907 г. Ricketts ив 1916 г. Fricks сообщили, что суспензия из яиц инфицированных клещей иногда не вызывает у морских свинок выраженного заболевания, но обеспечивает приобретение животным невосприимчивости к вирулентной культуре риккетсий Риккетса. Изучению этого явления были посвящены исследования, проведенные Spencer (1923, 1926), а также Parker и Spencer (1924). Было установлено, что суспензии из инфицированных голодных клещей D. andersoni, длительно хранившихся при низкой температуре, не вызывают у морских свинок выраженного заболевания, но обеспечивают приобретение животными невосприимчивости к вирулентным культурам риккетсий Риккетса. Выдерживание таких клещей при 37° или кормление на здоровой морской свинке резко повышает патогенность риккетсий Риккетса, которые становятся способными вызывать у морских свинок тяжелую форму пятнистой лихорадки. Указанное изменение свойств риккетсий было названо Spencer и Parker феноменом реактивации. Реактивация риккетсий Риккетса в клещах имеет, по мнению авторов, большое значение для эпидемиологии пятнистой лихорадки Скалистых гор.
Доказательством изменения в процессе реактивации именно свойств риккетсий Риккетса, а не их концентрации, по данным Spencer и Parker (1930), является отсутствие видимого изменения количества риккетсий в клещах до и после их кормления или выдерживания в термостате. Позднее, однако, было высказано предположение о том, что в напитавшихся кровью клещах, кроме повышения патогенности риккетсий Риккетса, происходит и их активное размножение.
В соответствии с исследованиями Harrell (1949) вирулентность и инфекционность риккетсий Риккетса повышаются при наличии в пищеварительном тракте крови животного в течение 2 - 8 часов.
Таким образом, как показали исследования Spencer и Parker, после введения суспезии из клещей D. andersoni, инфицированных высоковирулентным штаммом риккетсий Риккетса, у морских свинок могут развиться следующие три формы экспериментального риккетсиоза: 1) инаппарантная форма, протекающая без каких - либо клинических симптомов, но обеспечивающая приобретение животным невосприимчивости к вирулентной культуре риккетсий Риккетса; 2) умеренная по тяжести форма, но сопровождающаяся развитием основных клинических симптомов; 3) выраженная форма заболевания с частым смертельным исходом. Первая из указанных форм заболевания развивается при введении морским свинкам суспензии из длительно хранившихся при низкой температуре голодных клещей, вторая - при использовании тех же клещей, но предварительно выдержанных 24 часа при 37°, третья форма - при инъекции суспензии из тех же клещей, но предварительно накормленных на здоровой морской свинке (Spencer и Parker, 1924). В соответствии с указанными особенностями клинических проявлений пятнистой лихорадки у морских свинок Spencer и Parker допускают возможность существования вирулентных штаммов риккетсий Риккетса в следующих трех фазах: 1) неинфекционная, но иммунизирующая морских свинок фаза (содержится в голодных перезимовавших клещах); 2) высокоинфекционная и вирулентная фаза (содержится в напитавшихся кровью клещах); 3) фаза, которая обладает меньшей способностью к пенетрации и инвазии, чем вторая фаза, что проявляется в ее неспособности заражать морских свинок через неповрежденную кожу, конъюнктиву и слизистую оболочку пищеварительного тракта (Spencer и Parker, 1930). Последняя фаза наиболее характерна для риккетсий, находящихся в крови и органах больных животных.

Таблица 21. Свойства авирулентной и вирулентной фаз вирулентных штаммов риккетсий Риккетса (по Price, 1953, 1954)
Примечание: Риккетский, находившихся в авирулентной фазе, вводили морским свинкам в количестве 100 LD50 для куриных эмбрионов, а находившихся в вирулентной фазе - по I LD50.
Впоследствии изучение свойств различных фаз риккетсий Риккетса было осуществлено Price (1953, 1954). По его мнению, иммунизирующий эффект определенных фаз риккетсий Риккетса обусловлен не преобладанием мертвых риккетсий или содержанием небольшого количества живых риккетсий, но зависит от качественного состояния возбудителя. В дополнение к данным Spencer и Parker авирулентная фаза риккетсий Риккетса была обнаружена Price во всех фазах развития клеща, т. е. в яйцах, личинках, нимфах и взрослых особях. По данным Price, риккетсии, находящиеся в авирулентной фазе, не могут пассироваться на морских свинках из-за плохого накопления в органах животного. Однако уже после первого пассажа на развивающихся куриных эмбрионах авирулентная фаза риккетсий приобретает свойства вирулентной фазы. Авирулентная и вирулентная фазы риккетсий Риккетса, резко отличаясь по активности для морских свинок, обладают одинаковой активностью для 5 - дневных куриных эмбрионов, что позволяет оценивать их концентрации титрованием на развивающихся куриных зародышах с определением дозы, обеспечивающей гибель 50% эмбрионов (1 LD50). Как видно из представленных в табл. 21 основных свойств обеих фаз вирулентных штаммов риккетсий Риккетса, кроме различной активности для морских свинок, эти фазы отличаются по способности обеспечивать приобретение морскими свинками невосприимчивости к риккетсиям Конора и по активности в отношении обезьян цинамольгус, кроликов, бурундуков и колумбийских хомячков (Citellus columbianus), у которых суспензия из клещей, находившихся около 5 месяцев при 6°, не вызвала выраженного заболевания, но обеспечила невосприимчивость к вирулентной культуре риккетсий Риккетса. Общая реакция и иммунологическая перестройка организма животного на введение авирулентной фазы риккетсий Риккетса, по данным Price, не отличаются от реакции на инъекцию вакцины, представляющей инактивированную культуру вирулентной фазы риккетсий, хотя титр комплементсвя - зывающих и антитоксических антител в сыворотке вакцинированных животных был ниже (Price, 1954).
Кроме высоковирулентных штаммов типа R, вирулентная и авирулентная фазы риккетсий Риккетса были обнаружены у штаммов типов S и T, причем реактивация у них происходила при тех же условиях, что и у штаммов типа R. Так, закономерная реактивация авирулентной фазы штаммов типов S и T отмечалась при кормлении клещей на морских свинках и при выдерживании инфицированных клещей 24 часа при 37° (Price, 1954).
Поскольку авирулентная и вирулентная фазы были обнаружены у типов R, S и T штаммов риккетсий Риккетса, возник законный вопрос, не являются ли типы S, T и U различными вариантами типа R. Против такого предположения, по мнению Price, свидетельствуют следующие обстоятельства: 1) штаммы типа R, S, T и U могут длительно поддерживаться на куриных эмбрионах без изменения патогенных свойств, тогда как один пассаж на курином зародыше вызывает реактивацию авирулентной фазы любого типа, 2) штаммы типа R, S, T и U удается дифференцировать иммунологически с помощью вакцинации морских свинок с последующей оценкой восприимчивости животных к гомологичным и гетерологичным штаммам, тогда как различные фазы одного штамма таким методом отличить нельзя, 3) штаммы типа S и T возможно длительно поддерживать многочисленными пассажами по схеме клещ - животное - клещ и т. д. без изменения исходных свойств, однако уже однократное кормление клеща на животном приводит к реактивации авирулентной фазы риккетсий, 4) в клещах риккетсии штамма типа R, находясь в авирулентной фазе, выживают по крайней мере 3 года, после чего могут снова приобрести свойства вирулентной фазы, 5) в природе ймеются эндемичные очаги пятнистой лихорадки Скалистых гор, в которых встречаются только типы T или U риккетсий Риккетса.
Кроме отмеченной фазовой вариации патогенности риккетсий Риккетса, некоторые изменения свойств риккетсий были обнаружены при метаморфозе инфицированных клещей D. andersoni. Так, в опытах Price (1954) в нимфах, зараженных вирулентной фазой риккетсий типа R, до превращения в имаго содержалась вирулентная фаза риккетсий, вызывавшая у морских свинок 8-дневную лихорадку, скротальную реакцию и гибель около 30% животных. Сразу после превращения в имаго в клещах была обнаружена менее вирулентная форма риккетсий, которая при инъекции тех же количеств (количество риккетсий определялось титрованием на куриных эмбрионах) вызывала у морских свинок 3 - 4-дневное доброкачественное заболевание, протекавшее без периорхита и заканчивавшееся выздоровлением животных. Риккетсии Риккетса, обнаруженные в малопатогенной фазе сразу после линьки клещей, в отличие от авирулентной фазы из длительно хранившихся при низкой температуре голодных клещей хорошо размножались в морских свинках и после 2 пассажей с использованием для заражения очередных животных суспензии из селезенки приобретали свойства высоковирулентной фазы. В целом указанные наблюдения позволили Price высказать предположение о влиянии гормонов линьки клеща на свойства содержащихся в клещах риккетсий Риккетса.
Наряду с отмеченной изменчивостью патогенности риккетсий Риккетса в условиях живого организма (клещ) некоторые наблюдения свидетельствуют о возможности обратимой изменчивости риккетсий Риккетса in vitro.
Так, в соответствии с наблюдениями Gilford и Price (1955) вирулентная фаза риккетсий Риккетса после контакта in vitro при 25° в течение 60 минут с параамино-бензойной кислотой, взятой в концентрации 5 мг/мл, утрачивает способность вызывать у морских свинок выраженную форму заболевания, сохраняя, однако, исходную активность в отношении развивающихся куриных эмбрионов. Парагидроксибензойная кислота, коэнзим I и коэнзим А, добавленные к парааминобензойной кислоте, препятствуют утрате риккетсиями патогенности для морских свинок. Авирулентная фаза риккетсий Риккетса, содержащихся в длительно хранившихся при низкой температуре голодных клещах, после контакта in vitro в течение 6 часов при 25 - 30° с коэнзимом I, коэнзимом A, экстрактом из взрослых неинфицированных клещей, находившихся 24 часа при 35° или выдержанных с экстрактом из неинфицированных напитавшихся нимф, приобретает свойства вирулентной фазы. Превращение авирулентной фазы риккетсий Риккетса в вирулентную зависело от активности коэнзима I, так как его разрушение пирофосфатазой змеиного яда вызывало утрату способности коэнзима обеспечивать реактивацию риккетсий.
Кроме различной патогенности для морских свинок, авирулентная и вирулентная фазы риккетсий Риккетса обладают неодинаковой способностью адсорбироваться на измельченной ткани влагалищной оболочки яичек морской свинки. Так, авирулентная фаза практически не адсорбируется, с увеличением вирулентности риккетсий для морских свинок способность к адсорбции повышается.
Таким образом, согласно исследованиям Gilford и Price, патогенные свойства риккетсий Риккетса в иксодовых клещах обусловлены наличием или отсутствием в клещах некоторых энзимных систем. Price полагает, что повышение вирулентности риккетсий Риккетса при воздействии коэнзимом I связано с его стимулирующим влиянием на дыхание риккетсий, а незначительная патогенность одной из фаз риккетсий обусловлена невозможностью их адсорбции клетками и неспособностью к проникновению в клетки. Для обеспечения этих процессов, очевидно, необходим коэнзим A, коэнзим I или некоторые другие вещества (Price, 1953).
Наряду с отмеченными различиями в биологической активности отдельных штаммов риккетсий Риккетса и фазовой вариацией патогенности риккетсий были зарегистрированы изменения свойств риккетсий Риккетса при выращивании в лаборатории.
Так, в опытах Anigstein и Bader (1943) выделенные от погибших людей штаммы риккетсий Риккетса оказались малопатогенными для морских свинок, однако после нескольких пассажей на морских свинках патогенность штаммов значительно увеличилась. Аналогичное повышение патогенности штамма, выделенного из мышей Microtus pennsylvanicus, при пассажах на морских свинках отметили Gould и Miesse (1954). Однако в опытах King (1930) при пассажах на морских свинках с использованием крови или селезенки больного животного свойства риккетсий Риккетса не изменились. В том случае, когда ткань мозга больного животного хранилась в глицерине, при пассажах на морских свинках для восстановления вирулентности риккетсий, по данным King, необходимо использовать кровь. В замороженной ткани мозга при - 7° риккетсии не утрачивали патогенности для морских свинок.
В соответствии с наблюдениями Price (1954) штаммы риккетсий Риккетса типа U из восточных районов США после 1 - 2 пассажей на развивающихся куриных эбрионах приобрели свойства, характерные для типа T. Штаммы рикетсий типа U из западных районов США, а также штаммы типа S не изменили свойств даже после 10 пассажей на куриных зародышах. После 8 - 11 пассажей на кроликах с использованием суспензии из селезенки штаммы типа R закономерно приобретали свойства типа S, а в одном случае даже типа T. Эти наблюдения Price совпадают с наблюдениями Foot (1919) о снижении высоковирулентными штаммами риккетсий Риккетса патогенности для морских свинок при пассажах на кроликах.
В опытах Price (1954) пассажи штамма R на собаках и опоссумах вызвали уменьшение патогенности риккетсий для морских свинок, однако при пассажах на колумбийских хомячках и диких мышах свойства штамма не изменились. Пассажи на собаках и мышах вызвали снижение патогенности штаммов T и S для морских свинок. В тех случаях, когда очередное животное инфицировали не суспензией из селезенки, а при кормлении на нем нимф клещей D. andersoni, вирулентность штамма R не уменьшалась. Штаммы риккетсий, снизившие вирулентность для морских свинок в результате пассажей на кроликах, собаках и опоссумах, после нескольких пассажей на морских свинках вновь восстанавливали исходные свойства. Таким образом, свойства риккетсий Риккетса изменялись лишь при последовательных пассажах на некоторых животных, но сохранились при пассажах на тех же животных с помощью клещей D. andersoni.
Определенный интерес представляют наблюдения Price (1954) о влиянии на свойства риккетсий Риккетса пассажа на человеке. В одном случае из клеща D. variabilis, обусловившего инфицирование человека, были выделены риккетсии Риккетса типа U. После пассажа на курином эмбрионе и культуре тестикулярной ткани человека риккетсии приобрели свойства типа T. Из крови больного человека на морских свинках был выделен тип T риккетсий Риккетса. Таким образом, содержавшийся в клеще тип U риккетсий повысил вирулентность для морских свинок при пассаже на человеке, при выращивании в культуре тестикулярной ткани человека и в куриных эмбрионах.
Проведение типа R риккетсий Риккетса через три полных жизненных цикла клеща H. leporis - palustris с кормлением клещей на кроликах, через четыре цикла клеща D. variabilis с кормлением имаго на собаках и типа S через четыре цикла клещей D. andersoni не отразилось на исходных свойствах риккетсий Риккетса (Price, 1954).
Как свидетельствуют наблюдения Сох (1941), при адаптации к развивающимся куриным эмбрионам риккетсии Риккетса могут повышать вирулентность, однако после многочисленных пассажей на куриных зародышах вирулентность риккетсий для морских свинок и обезьян снижается. Так, в опытах Сох после многочисленных пассажей на куриных эмбрионах риккетсии стали вызывать у морских свинок доброкачественную, а иногда бессимптомную форму пятнистой лихорадки, хотя их концентрация, определенная на основании приобретения животными невосприимчивости к вирулентной культуре риккетсий, существенно не изменилась.
В 1954 г. Parker с соавторами сообщили о выделении из крови больного человека высоковирулентного штамма риккетсий Риккетса. Больной затем лечился антибиотиками. Спустя год у него был вырезан лимфатический узел, из которого после 28 - месячного хранения при - 73° были выделены риккетсии Риккетса. Новый штамм вызвал у морских свинок лишь незначительное повышение температуры, но периорхит не развился. Авторы полагают, что в данном случае имело место снижение вирулентности риккетсий Риккетса в результате химиотерапии или длительного пребывания в иммунном организме. Не исключено, однако, что свойства риккетсий изменились при длительном хранении лимфатического узла в замороженном состоянии.
Исследованиями Price (1953) было установлено, что при некоторых условиях малопатогенные штаммы риккетсий Риккетса способны предохранить морских свинок от высоковирулентных культур риккетсий Риккетса. Так, у абсолютного большинства морских свинок, инфицированных 105,5 ED50 штамма типа T и спустя 4 часа 104 ED50 штамма типа R, развивалась доброкачественная форма риккетсиоза, свойственная штамму типа T. В противоположность животным, инфицированным только культурой риккетсий типа R, у морских свинок, получивших как R, так и T типы риккетсий, лихорадочная реакция была непродолжительной, периорхит обычно не развивался и заболевание заканчивалось выздоровлением.
В другой серии опытов от кроликов, полевок и колумбийских хомячков, на которых одновременно кормилось большое количество клещей, инфицированных штаммом типа T, и меньшее количество клещей, содержавших штамм типа R, Price удалось путем подсадки свежей партии клещей выделить только штамм типа T. У морских свинок после одновременного кормления клещей - носителей штаммов типа T и R развивалась доброкачественная форма заболевания, характерная для типа T, но при подсадке того же количества клещей, зараженных только штаммом типа R, развивалось тяжелое заболевание. Аналогичным образом штамм типа U препятствовал размножению штамма типа R, введенного по крайней мере в 10 раз меньшей дозировке (Price с соавторами, 1954).
Некоторое защитное действие наблюдалось при введении за 3 часа до заражения не менее 107 телец риккетсий Риккетса, предварительно очищенных целитом и инактивированных ультрафиолетовыми лучами. При инъекции инактивированных риккетсий через 3 часа после заражения животного защитное влияние отсутствовало. В случае введения менее 107 телец инактивированных риккетсий морские свинки оказывались незащищенными даже от 100 риккетсий Риккетса. Наконец, защита 80 - 90% животных от вирулентной культуры риккетсий Риккетса обеспечивалась инъекцией за 3 часа до заражения препарата, приготовленного из инфицированных желточных оболочек по методике Bovarnick и Miller (1950), подвергнутого ультразвуковой обработке и очищенного от корпускулярных частиц центрифугированием при 30 000 g в течение 1 часа при 5°. Инъекция препарата, не подвергавшегося ультразвуковой обработке, не обеспечивала защиту морских свинок от штамма типа R риккетсий Риккетса (Price с соавторами, 1954). Таким образом, в этих исследованиях было показано, что интерференция, наблюдаемая при инъекции животному различных вариантов риккетсий Риккетса, обусловлена не их концентрацией в одних и тех же клетках, а скорее зависит от общей защитной реакции организма, изменяющейся в результате предварительной инъекции малопатогенных штаммов инактивированных риккетсий и препаратов, полученных ультразвуковым разрушением риккетсий Риккетса.
Давая общую оценку опубликованным материалам по биологической активности риккетсий Риккетса, прежде всего необходимо отметить значительную изменчивость этого вида риккетсий, главным образом вирулентности. Биологическая активность риккетсий Риккетса обусловлена как принадлежностью к определенной разновидности, так и конкретным состоянием риккетсий, в частности характером окружающей среды, например условиями хранения и питания носителей риккетсий - клеща D. andersoni. Так, при обнаружении в клещах биопробой на морских свинках риккетсий Риккетса со свойствами типа U не представляется возможным сказать, действительно ли это риккетсии типа U или выявленные риккетсии являются малопатогенной фазой типов R, S и T, патогенность которой для морских свинок подобна патогенности типа U. Ответ на такой вопрос можно дать лишь после попытки реактивации возбудителя пассажем на развивающихся куриных эмбрионах или кормлением клещей.
Зависимость свойств риккетсий от условий существования, вероятнее всего, имеет определенное значение в возникновении весьма отличающихся вариантов риккетсий Риккетса и в генезе таких родственных видов риккетсий, как возбудители ряда разновидностей марсельской лихорадки, клещевого сыпного тифа Северной Азии, везикулезного (оспоподобного) риккетсиоза и некоторых других представителей группы клещевых пятнистых лихорадок. Различия в биологических свойствах штаммов клещевого сыпного тифа Северной Азии были показаны рядом советских исследователей (Е. М. Голиневич, 1953; С. М. Кулагин, 1953, и др.).
|
ПОИСК:
|
© BIOLOGYLIB.RU, 2001-2020
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'
При копировании ссылка обязательна:
http://biologylib.ru/ 'Библиотека по биологии'